
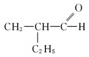
 的醇是( )
的醇是( )| A. | 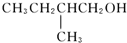 | B. | 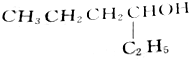 | ||
| C. | 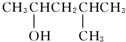 | D. | 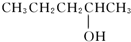 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在硫酸催化下水解,只生成葡萄糖 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 1L1mol•L-1AlCl3溶液中含Al3+数目为6.02×1023 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
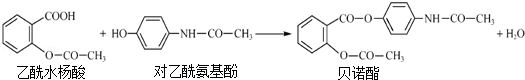
| A. | 1mol贝诺酯分子可与7molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
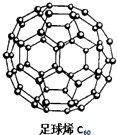 C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60分子内共用电子对数目相同 | |
| C. | 由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa | B. | CH3COOH和CH3COONa | ||
| C. | CH3COONa和NaOH | D. | CH3COOH和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 酸性强弱:HIO4>HBrO4>HClO4 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com