
| A. | 2SO2(g)+O2(g)═2SO3(l)+Q,Q>196.64kJ | |
| B. | 2mol SO2气体和过量的O2充分反应放出196.64kJ热量 | |
| C. | 1 L SO2(g)完全反应生成1L SO3(g),放出98.32 kJ热量 | |
| D. | 使用催化剂,可以减少反应放出的热量 |
分析 A、气态变成液态要放出热量;
B、热化学方程式是2mol的二氧化硫完全转化,而2mol SO2气体和过量的O2充分反应不可能完全反应;
C、状况不知无法由体积求物质的量;
D、使用催化剂不影响热效应.
解答 解:A、气态变成液态要放出热量,所以2SO2(g)+O2(g)═2SO3(l)+Q,Q>196.64kJ,故A正确;
B、热化学方程式是2mol的二氧化硫完全转化,而2mol SO2气体和过量的O2充分反应不可能完全反应,所以热量放出小于196.64kJ,故B错误;
C、状况不知无法由体积求物质的量,故C错误;
D、使用催化剂平衡不移动,不影响热效应,所以放出的热量不变,故D错误;
故选A.
点评 以反应热的计算为载体,考查可逆反应的不完全性,注意可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 长期放置的苯酚晶体变红 | B. | 硝酸银晶体光照后变黑 | ||
| C. | 氢氧化亚铁变灰绿再变红褐 | D. | 二氧化碳气体冷却后变淡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 分子晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰熔化时水分子中共价键发生断裂 | |
| D. | CaCl2晶体中含有两种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/L CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol/LNaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/L( NH4)2CO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
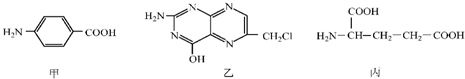
 .
.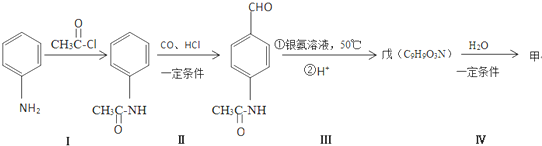
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
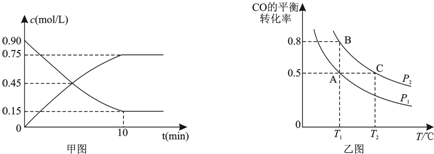
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,将pH=a的一元强酸溶液与pH=14-a的一元碱溶液等体积混合后,所得溶液呈酸性或中性 | |
| B. | 相同温度的盐酸和醋酸两种溶液中,若c(Cl-)=c(CH3COO-),则两溶液pH相同 | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) | |
| D. | 对于沉淀溶解平衡AgX?Ag++X-,已知AgCl的平衡常数大于AgI.则含AgCl和AgI固体的悬浊液中存在:c(Ag+)>c(I-)>c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com