
【题目】向200mL0.1mo/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再充分灼烧后得到固体的质量为( )
A.1.44gB.1.6gC.1.8gD.2.14g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为____,为何此种情况能测出NaOH的含量?____。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?____,请说明理由:___。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后用5.0×10-4mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-=2I-+S4O62-)。取用Na2S2O3的标准溶液应该用_____式滴定管。有关实验数值如表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
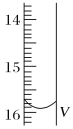
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | V=_____ |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为_____,下列操作中,会导致所测得的碘元素的百分含量偏大的是____。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是
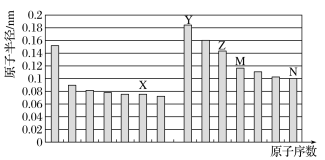
A.M在周期表中的位置为:第三周期,IV族
B.Y和N形成的化合物为离子化合物
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在2L恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平均反应速率为0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有____(填字母代号)。
2NH3(g) ΔH=92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有____(填字母代号)。
a.增大压强 b.升高温度 c.增大N2浓度
d.及时移走生成物NH3 e.使用高效催化剂
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
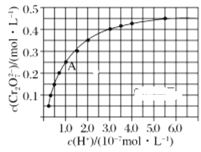
①用离子方程式表示Na2CrO4溶液中发生的转化反应____。
②由图可知,溶液酸性减弱,CrO42-的平衡转化率____(填“增大”、“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为____。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH___0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH__0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol/(L·s);反应的平衡常数K1为_____。

(2)100℃时达到平衡后,改变反应温度为T,N2O4以平均速率0.002 0mol/(L·s)降低,经10s又达到平衡。
①T___100℃(填“大于”或“小于”)
②计算温度T时反应的平衡常数K2为_____。
(3)温度T时反应达平衡后,将反应容器的容积增大一倍。平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】培哚普利主要用于治疗高血压与充血性心力衰竭,其合成路线如下:

已知:ⅰ. ![]()
ⅱ.DCC是一种很强的脱水剂。
(1)芳香烃A的名称是___________________。
(2)B→C所需的试剂及条件是________________。
(3)C→D的化学方程式是____________________。
(4)D→E的反应类型是______________________。
(5)F的结构简式是____________________________。
(6)K存在互变异构体K′,G可由如下路线合成:

①X含有五元环和碳碳双键,其结构简式是______。
②上述合成培哚普利的路线中,将Y转化为G,再与F反应,而不直接用Y的主要目的是______,与合成路线中______________填字母)的转化目的相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.Na2O2溶于水:Na2O2+2H2O=2Na++2OH﹣+O2↑
B.用石墨电极电解饱和食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑
C.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4+CO32-=CaCO3+SO42-
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++SO42-=BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com