
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
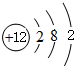 ;画出BC2的电子式
;画出BC2的电子式 ,结构式O=C=O,其晶体类型为分子晶体
,结构式O=C=O,其晶体类型为分子晶体 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4m}{n}$ | B. | $\frac{22400m}{n}$ | C. | $\frac{22400n}{m}$ | D. | $\frac{n}{22.4m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.
在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13 | B. | 13 | C. | 11 | D. | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com