
【题目】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:

请回答:
(1) X 的化学式是______。
(2) 固体甲与稀硫酸反应的离子方程式是______。
(3) 写出 X 在隔绝空气高温反应的化学方程式______。
【答案】 CuO Cu2O+2H+= Cu+Cu2++2H2O 4CuO ![]() O2↑+2 Cu2O
O2↑+2 Cu2O
【解析】16gX隔绝空气加热分解放出了能使带火星的木条复燃的气体为氧气,质量为1.6g,证明X中含氧元素。根据质量守恒定律可知固体甲的质量是16g-1.6g=14.4g,固体甲和稀硫酸溶液反应生成蓝色溶液,说明含铜离子,证明固体甲中含铜元素,即X中含铜元素,结合质量守恒定律分析回答。
流程中16gX隔绝空气加热分解放出了能使带火星的木条复燃的气体为氧气,质量为1.6g,证明X中含氧元素。根据质量守恒定律可知固体甲的质量是16g-1.6g=14.4g,固体甲和稀硫酸溶液反应生成蓝色溶液,说明含铜离子,证明固体甲中含铜元素,即X中含铜元素。铜元素和氧元素形成的黑色固体为CuO,X为氧化铜,n(CuO)=16g÷80g/mol=0.2mol,结合质量守恒得到n(O2)=1.6g÷32g/mol=0.05mol,氧元素守恒得到甲中n(Cu):n(O)=0.2mol:(0.2mol-0.05mol×2)=2:1,即固体甲的化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜。则
(1)根据以上分析可知X为CuO;
(2)固体甲为Cu2O,氧化亚铜和稀硫酸溶液发生歧化反应生成铜、二价铜离子和水,反应的离子方程式为Cu2O+2H+=Cu+Cu2++2H2O;
(3)根据以上分析可知氧化铜在隔绝空气高温反应的化学方程式为4CuO![]() O2↑+2Cu2O。
O2↑+2Cu2O。


科目:高中化学 来源: 题型:
【题目】已知HClO的酸性比H2CO3弱,下列反应Cl2+H2OHCl+HClO达到平衡后,要使平衡体系中HClO的浓度增大,应采取的方法是( )
A.加入石灰石
B.光照
C.加入固体NaOH
D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.可以利用铝热反应冶炼高熔点的金属
B.现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100%
C.工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可
D.煤直接液化可得液体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中的各项性质,属于CH4、C2H4共性的是( )
A. 常温常压下是无色无味气体 B. 在通常状况下,密度比空气小
C. 它们都属于饱和烃 D. 在一定条件下能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计的糖厂甘蔗渣利用方案如下图所示:

其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6” 所示物质的名称是______; A的结构简式为_____;C中官能团的名称为______。
(2)写出下列转化的化学方程式并指出反应类型:
CH3CH2OH → CH3CHO:______, 反应类型为_______。
(3)下列说法正确的是______。
A.目前生产A的主要方法是石油的裂解,其产量是衡量一个国家化工水平的标志之一
B.分馏石油得到的各个馏分为纯净物
C.动物的脂肪在酸性条件下水解可以得到肥皂的主要成分
D.塑料、合成橡胶、合成纤维、淀粉都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136 kJ/mol
②C2H6(g)+ ![]() O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O(g) |
键能( kJ/mol) | 436 | X | 496 |
由此计算x=_________,通过比较△H1和△H2,说明和热裂解法相比,氧化裂解法的优点是_______________________________(任写一点)。
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是______,反应的最佳温度为____________(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
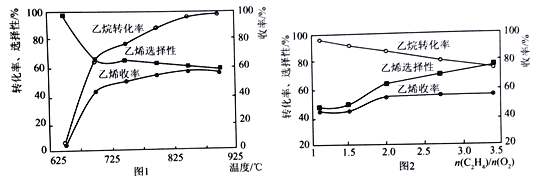
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中n(C2H6)/n(O2)的最佳值是_______________,判断的理由是__________________________________。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___________________________。
反应达平衡时,各组分的体积分数如下表:
C2H6 | O2 | C2H4 | H2O | 其他物质 |
2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=_________(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是构成细胞的最基本元素,对此最有说服力的解释是
A. 碳在细胞的各种化合物中含量最多 B. 碳在自然界中含量最为丰富
C. 在细胞的各种化合物中都含有碳 D. 碳链构成了有机物的基本骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
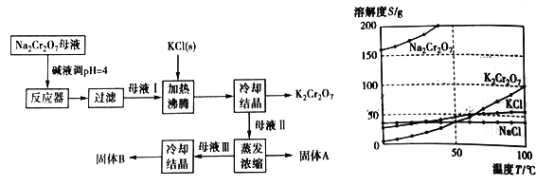
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。固体B的主要成分为___________________(填化学式)。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。进一步提纯产品的方法是___________________。
(5)+6价Cr的毒性很高,工业上用电解法来处理含Cr2O72-的废水。下图为电解装置示意图,电极材料分别为铁和石墨。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a 极附近变成Cr(OH)3沉淀而被除去。
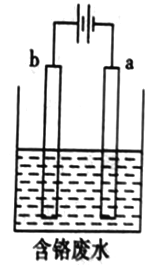
①在以上处理过程中,Cr2O72-转化为毒性较低的Cr3+的离子方程式为________________________。
②a电极的电极反应式是是____________________;电解一段时间后在阴极区有Fe(OH)3和Gr(OH)3沉淀生成,若电解后的溶液中c(Cr3+)为3×10-5mol·L-1,则溶液中c(Fe3+)为____________ mol·L-1。已知:Ksp=[Fe(OH)3]=4.0×10-38,K[Cr(OH)3]=6.0×10-31。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com