
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低
于16.2 ℃
科目:高中化学 来源: 题型:
374 ℃、22.1 MPa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水 ( )
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2溶液中逐滴加入过量的稀盐酸;③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________________________________________________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为________________________________________________________________________;
上述现象说明溶液中________结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
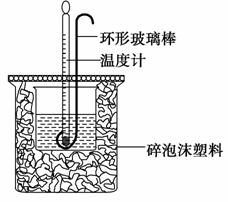
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是________________________________________________________________
_______________________________________________________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_______________________________________________________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
肉桂醛是一种食用香精,广泛应用于牙膏、糖果及调味品中。工业中可以通过下列反应制得:
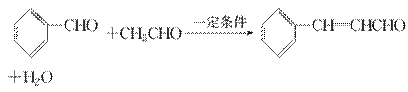
下列说法不正确的是 ( )。
A.肉桂醛的分子式为C9H8O
B.检验肉桂醛中是否残留有苯甲醛:加入酸性KMnO4溶液,看是否褪色
C.1 mol肉桂醛在一定条件下与H2加成,最多消耗5 mol H2
D.肉桂醛中所有原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
比较下列四组反应,回答下列问题。
一组:①Na2O2+CO2
②Na2O2+SO2
二组:③Na2O2+FeCl3(溶液)
④Na2O2+FeCl2(溶液)
三组:⑤SO2通入品红溶液中,加热
⑥Na2O2加入到品红溶液中,加热
四组:⑦NaOH溶液滴入紫色石蕊溶液中
⑧Na2O2固体加入到紫色石蕊溶液中
问题:(1)写出①、②两反应的化学方程式。
(2)判断③、④反应中可能发生的现象,为什么?
(3)判断⑤、⑥反应中可能发生的现象,为什么?
(4)判断⑦、⑧反应中可能发生的现象?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.原子核外电子在某一时刻的位置可以测定或计算出来
B.原子核外电子的运动轨迹可以描画出来
C.人们常用小黑点的疏密程度来表示电子在原子核外出现概率的大小
D.电子云图中的小黑点表示电子的个数多少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com