
����Ŀ��A��B��C��D��E��F��ʾ����10�����ӵ�������ش�
��1��A����Ϊ����������Aԭ��������������ԭ�Ӱ뾶�����A������______���������ӷ��ţ�
��2��D��������Ԫ����ɵķ��ӣ���ˮ��Һ�ʼ��ԣ�D�Ľṹʽ��_______________��
��3����B����Һ�м��뺬F����Һ���ȳ��ְ�ɫ�������������뺬F����Һ�����ܽ⣬д���ù��̵����ӷ���ʽ__________________________________
��4����E����Һ�м��뺬F����Һ������������ C��D��д�������ӷ���ʽ____________________��
���𰸡� Na+ ![]() Al3++3OH-=Al��OH��3����Al��OH��3+OH-=AlO2-+H2O NH4++OH-=NH3��+H2O
Al3++3OH-=Al��OH��3����Al��OH��3+OH-=AlO2-+H2O NH4++OH-=NH3��+H2O
������������������10�����ӵ����У�Ne��CH4��NH3��H2O��HF��NH4+��OH-��H3O+��O2-��F-��Na+��Mg2+��Al3+�ȣ����ݸ����ӵ���ɺ����ʽ����⡣
��⣺����10�����ӵ����У�Ne��CH4��NH3��H2O��HF��NH4+��OH-��H3O+��O2-��F-��Na+��Mg2+��Al3+�ȣ���
��1��A����Ϊ����������Aԭ��������������ԭ�Ӱ뾶�����AΪNaԪ�أ�A������Na+��
��2��������Ԫ����ɵķ��ӣ���ˮ��Һ�ʼ��Ե�������NH3���ṹʽΪ![]() ��
��
��3����B����Һ�м��뺬F����Һ���ȳ��ְ�ɫ�������������뺬F����Һ�����ܽ⣬��BΪAl3+��FΪOH-����Ӧ�����ӷ���ʽ�ֱ�Ϊ��Al3++3OH-=Al��OH��3����Al��OH��3+OH-=AlO2-+H2O��
��4�������Ϸ�����֪EΪNH4+��FΪOH-��CΪNH3��DΪH2O����Ӧ�����ӷ���ʽΪNH4++OH-=NH3��+H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���仯����㷺�������ء���е���졢���»�������ҵ��
��1��Ǧ��̼��ͬ��Ԫ�أ���̼��4�����Ӳ㡣Ǧ��Ԫ�����ڱ���λ��Ϊ_________��
��2��Ǧ������һ����;�㷺�Ķ��ε�ء�Ǧ���صĵ�ط�Ӧͨ����ʾ���£�Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O��
2PbSO4 +2H2O��
Ǧ���س��ʱ��������Ǧ�缫Ӧ����ӵ�Դ��_________________�����������������������������ӣ��õ缫�ĵ缫��ӦʽΪ________________________________��
��3�����õ�ⷨ���Ƶý���Ǧ����PbO�ܽ���HCl��NaCl�Ļ����Һ�У��õ���[PbC14]2-�ĵ��Һ���ö��Ե缫���Na2PbCl4��Һ�Ƶý���Pb��װ������ͼ��ʾ��
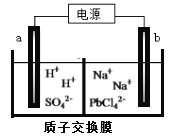
a�缫��������__________��b�缫�ĵ缫��ӦʽΪ______________________
��4��PbO2����ͨ��ʯīΪ�缫���Pb(NO3)2 ��Cu(NO3)2�Ļ����Һ��ȡ��������������Ӧ�ĵ缫��ӦʽΪ______________�������Ϲ۲쵽��������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A. SO2��ʹƷ����Һ��ɫ������ΪSO2���������Խ�Ʒ������
B. 9g ��ˮ��D2O���к���5mol����
C. Ũ�����е�HNO3�����ֽ⣬����ʱ��ʵ���ҿ�����Ũ����ʻ�ɫ
D. ͬλ�ص��������ʺͻ�ѧ������ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ�ͼ�ʽ̼����þ[MgaAlb��OH��c��CO3��dxH2O]�����������ж����ż�Ϊ��Ҫ��Ӧ�ã�ij�о�С���������ʯ��ȡ�������������ʣ��Լ���ʽ̼����þ�����չ���������о���������벢��ɶ��й�����Ľ��
��1������ʯ����ȡ���ʺ�������������Ҫԭ�ϣ�����ʯ����ɺ��������ƣ�����������������������������ʣ�����ʵ�鲽����ͼ1��ʾ�� 
�ٲ���I������Ϊ
�ڻ�Ϸ��ϵ���Ҫ�ɷ�����д��ѧʽ����������Һ�����Ƿ���NH4+�ķ����ǣ�ȡ�ٻ���Һ�����Թ��У������м���������NaOH��Һ�����ȣ������������ܹ�ʹ �� ��֤����Һ���к���NH4+
��һ�������£����������������������Ӧ����������ĸ��
a��KSCN ��Һ b��Al c��NaOH ��Һ
�ܿ����ܹ�Ϊ������Ӧ�ṩ��������д��ѧʽ����
��2����ʽ̼����þ�dz���θҩ����ϲ������Ҫ�ɷ֣�Ϊȷ����ʽ̼����þ����ɣ�����������ʵ�飺
��ȡ��ʽ̼����þ��ĩ6.02g����������2.0molL��1����ʹ���ֻ�Ϸ�Ӧ����Ӧ�����в�����������V�����壩��������������V��HC1���Ĺ�ϵ��ͼ2��ʾ�����ʽ̼����þ����������̼��������ʵ���֮��Ϊ
�ڽ��ٷ�Ӧ��õ��Ļ��Һ�ٺ���������������Һ��ֻ�ϣ���Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48g�����ʽ̼����þ�Ļ�ѧʽΪ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪24mLŨ��Ϊ0.05mol/L ��Na2SO3��Һǡ����V mLŨ��Ϊ0.04mol/L��K2X2O7��Һ��ȫ��Ӧ���õ�XԪ���ڲ����еĻ��ϼ�Ϊ+3����VΪ
A. 40 B. 30 C. 20 D. 10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ��ܷϴ���(��Ҫ�ɷ�ΪCo��Fe��SiO2)Ϊԭ�ϣ���ȡ�����ܵ��������¡�
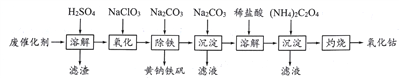
(1)�ܽ�:�ܽ����ˣ�������ϴ��2~3�Σ�ϴҺ����Һ�ϲ�����Ŀ����__________________��
(2)����:���Ƚ��������¼���NaC1O3����������_______________________________��
(3)����:����������Na2CO3������ȣ����ɻ�������Na2[Fe6(SO4)4(OH)12]������д���÷�Ӧ�Ļ�ѧ����ʽ:__________________________________________________��
(4)����:���ɳ�����ʽ̼����[(CoCO3)2��3Co(OH)2]��������ϴ�ӣ���������Ƿ�ϴ�Ӹɾ��IJ�����_________________________________________________________��
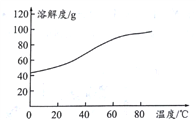
(5)�ܽ�:CoCl2���ܽ��������ͼ��ʾ�����ʽ̼�����м�������ϡ���ᣬ���ȱ߽�������ȫ�ܽ������ȹ��ˣ���ԭ����__________________________________��
(6)����:ȷ��ȡ����CoC2O4����2.205g���ڿ��������յõ��ܵ�һ��������1.205g��д����������Ļ�ѧʽ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ܴ����������( )
A.NH4+��Na+��NO3-��OH-B.Ca2+��Na+��Cl-��CO32-
C.K+��H+��SO42-��OH-D.Na+��K+��OH-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��ԭ���������ȷ����

A. ѡ����ʵ��Լ�����ͼ1��ʾװ�ÿɷֱ���ȡ����CO2��NO��O2
B. ��ȥ����CO2�л��е�����SO2���ɽ������������ͨ��ʢ����������KMnO4��Һ��Ũ�����ϴ��ƿ
C. ϴ�ӳ���ʱ(��ͼ2)����©���м�����ˮ��û���������裬��ˮ�˾����ظ�����
D. ����Ƶ����Һ©�������������Ȼ�̼���ã��ɽ�����ȡ�����Ȼ�̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������������մ����������ʳ�����ƣ�������ϴ�ӣ�����ϴ�����þߵ����۵ȡ��������������ַ������ֳ������õ�ʳ���봿��__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com