
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
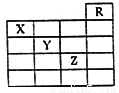
①X的气态氢化物与Y的最高价氧化物的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的酸性Y<Z
③Z的单质在常温下是液体,可与铁粉反应
④Z的原子序数比Y大19 ⑤Z所在的周期中含有32种元素
A.只有①②③④ B.①②③④⑤ C.只有③ D.只有①④
科目:高中化学 来源:2015-2016学年陕西省高二下学期期中考试化学试卷(解析版) 题型:选择题
由乙烯推测丙烯的结构或性质正确的是( )
A.分子中所有原子在同一平面上
B.与HCl加成只生成一种产物
C.能使KMnO4酸性溶液褪色
D.能与溴水发生取代反应而使溴水褪色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省南昌市八一等五校高二5月联考化学试卷(解析版) 题型:选择题
10.0 mL 某气态烃在 50.0 mL O2中充分燃烧,得到液态水和35.0 mL 的气体混合物(所有气体的体积都是在同温同压下测得的),则该气态烃可能是( )
A.CH4 B.C2H6 C.C3H8 D.C4H10
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高安市高一下期中化学试卷(解析版) 题型:实验题
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):

(1) 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大 ,(填序号,下同) ,原因是 。
(2) 哪一段时段的反应速率最小 ,原因是 。
(3) 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程) 。
(4) 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:[A.蒸馏水 B.NaCl溶液 C Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号) 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高安市高一下期中化学试卷(解析版) 题型:选择题
有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A.DCAB B.DABC C.DBAC D.BADC
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高安市高一下期中化学试卷(解析版) 题型:选择题
某元素X的气态氢化物的化学式为H2X,其最高价氧化物的水化物的化学式可能为
A.H2XO3 B..HXO3 C.HXO D.H2XO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省等四校高一下第二次月考化学试卷(解析版) 题型:实验题
丁烷催化裂解生成烷烃和烯烃,可按下列两种方式进行:C4H10→C2H4+C2H6;C4H10→C H4+C3H6某化学兴趣小组为了测定丁烷裂解气中CH4和C2H6的比例关系,设计实验如下图所示:
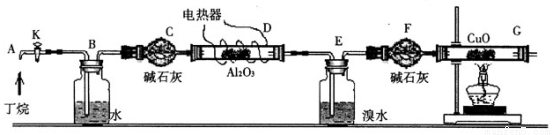
如图连接好装置后,需进行的操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
注:CuO能将烃氧化成CO2和H2O;Al2O3是烷烃裂解的催化剂;G后面装置已省略。
(1)这三步操作的先后顺序是_________(填序号)
(2)简要叙述证明空气已排尽的操作方法______________________。
(3)假定丁烷完全裂解,且流经各装置中的气体能完全反应。当装置E和F的总质量比反应前增加了0.7g,G装置中固体质量比反应前减少了1.76g,则在丁烷的裂解产物中CH4和C2H6的物质的量之比n(CH4):n(C2H6)=______________。
(4)若对实验后E装置中的混合物再按以下流程进行实验:
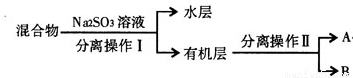

①分离操作I、Ⅱ的名称分别是:I、_____________,Ⅱ、____________。
②Na2SO3溶液的作用是______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省等四校高一下第二次月考化学试卷(解析版) 题型:选择题
设NA 代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
A.标准状况下,2.24L戊烷所含分子数为0.1 NA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有4NA 个氢原子
C.17.6g丙烷中所含的极性共价键为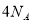 个
个
D.常温常压下,22.4L乙烯中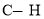 键数为4
键数为4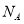
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一卷理综化学试卷(解析版) 题型:填空题
“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s)  Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s)  CaC2(s) K2 △H2=b KJ·mol-1
CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s)  3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。
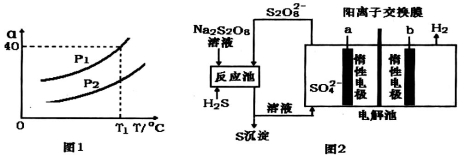
①利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率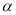 随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
②电化学法制取氢气的原理如图2,请写出反应池中发生反应的离子方程式_____,惰性电极a上发生的电极反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com