
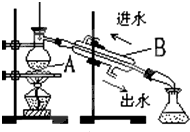
 蒸馏是实验室制备蒸馏水的常用方法.
蒸馏是实验室制备蒸馏水的常用方法.科目:高中化学 来源: 题型:阅读理解

| 物理性质 | 乙酸 | 乙醇 | 1-丁醇 | 乙酸乙酯 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -117.3 | -89.5 | -83.6 | -73.5 |
| 沸点(℃) | 117.9 | 78.5 | 117 | 77.06 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.79 | 0.81 | 0.90 | 0.88 |

查看答案和解析>>
科目:高中化学 来源: 题型:
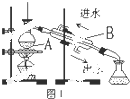 蒸馏是实验室制备蒸馏水的常用方法.
蒸馏是实验室制备蒸馏水的常用方法.查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三10月月考化学试卷(解析版) 题型:实验题
(15分)下表是实验室制备气体的有关内容:
|
编号 |
实验内容 |
实验原理 |
发生装置 |
|
① |
制氧气 |
|
|
|
② |
制氨气 |
|
|
|
③ |
制氯气 |
|
|
(1)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。
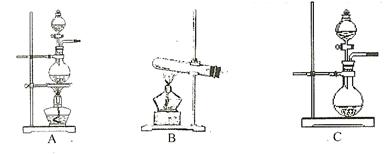
(2)上述气体中,从反应中有无电子转移的角度看,明显不同于其他气体的是 ,写出实验室制取该气体的化学方程式 .
(3)若用上述制备 的装置制备
的装置制备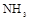 ,应选择的试剂为
.
,应选择的试剂为
.
(4)制备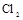 需用
需用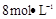 的盐酸1OOml,现用
的盐酸1OOml,现用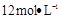 的盐酸来配制。
的盐酸来配制。
①需要用量筒量取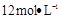 的盐酸的体积为 mL;
的盐酸的体积为 mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号) 。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.lOmL量筒 F.胶头滴管 G.lOOmL烧杯 H.lOOmL容量瓶
③下列实验操作中,不正确的是 (填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高三第一次统考化学试卷(解析版) 题型:实验题
(10分)单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
|
熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
|
升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+ 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由
。
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com