
分析 ①已知:Ⅰ、?6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
Ⅱ、?2H2(g)+O2(g)═2H2O(g)△H2
Ⅲ、?C(s)+O2(g)═CO2(g)△H3
根据盖斯定律,-Ⅰ×2+Ⅱ×5+Ⅲ×12可得:4C3H3(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g),反应热也进行相应计算;
②根据题意可知,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式;
③Ⅰ、Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
Ⅱ、S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Ⅲ、Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将Ⅲ-Ⅱ-Ⅰ可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
④电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2+H2O+2e-═Mn2O3+2OH-.
解答 解:①已知:Ⅰ、?6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
Ⅱ、?2H2(g)+O2(g)═2H2O(g)△H2
Ⅲ、?C(s)+O2(g)═CO2(g)△H3
根据盖斯定律-Ⅰ×2+Ⅱ×5+Ⅲ×12可得:4C3H3(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g),则△H=-2△H1+5△H2+12△H3,故答案为:-2△H1+5△H2+12△H3;
②根据题意,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,n(CO2)=0.5mol,n(NaOH)=1mol•L-1×0.75L=0.75mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xkJ/mol①,
又1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-ykJ/mol②,
由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)kJ/mol,故答案为:NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)kJ/mol;
③Ⅰ、Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
Ⅱ、S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Ⅲ、Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将Ⅲ-Ⅱ-Ⅰ可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol,故答案为:MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
④电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2+H2O+2e-═Mn2O3+2OH-,故答案为:2MnO2+H2O+2e-═Mn2O3+2OH-.
点评 本题考查运用盖斯定律计算反应热,关键是根据已知热化学方程式构造目标热化学方程式,注意对盖斯定律理解与应用.


科目:高中化学 来源: 题型:选择题
| A. | 甲苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 乙酸乙酯和甘油(丙三醇) | D. | 食盐水和泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A. | 通入的CO2气体为22.4 L | B. | A溶液中n(NaOH)=2n(Na2CO3) | ||
| C. | A溶液中既含Na2CO3,又含NaHCO3 | D. | A溶液中一定只有Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生取代反应而使溴水褪色 | |
| C. | 丙的二氯取代物同分异构体数与其四氯取代物的相等 | |
| D. | 1mol 乙或丁完全燃烧都消耗3mol O2,故二者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气中含有的氮氧化物是汽油不完全燃烧造成的 | |
| B. | 光导纤维、碳纤维、聚酯纤维都是新型无机非金属材料 | |
| C. | PM2.5(颗粒直径接近2.5×10-6m)分散在空气中能够产生丁达尔效应 | |
| D. | 以液化石油气代替燃油可减少大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
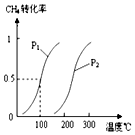 在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H
在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、Al(OH)3 | B. | AgNO3、NH4Cl | C. | MgSO4、BaCl2 | D. | CuCl2、Al(NO3)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com