
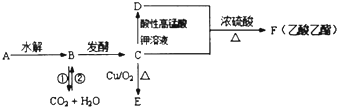
分析 A是一种遇到碘单质能变蓝的多糖,则A为:(C6H10O5)n (淀粉),水解生成B,且二氧化碳与水可以转化生成B,应是在光合作用,故B为C6H12O6(葡萄糖),葡萄糖发酵生成C为CH3CH2OH,CH3CH2OH在Cu作催化剂条件下氧化生成E为CH3CHO,CH3CH2OH被酸性高锰酸钾氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成F为CH3COOCH2CH3,据此解答.
解答 解:A是一种遇到碘单质能变蓝的多糖,则A为:(C6H10O5)n (淀粉),水解生成B,且二氧化碳与水可以转化生成B,应是在光合作用,故B为C6H12O6(葡萄糖),葡萄糖发酵生成C为CH3CH2OH,CH3CH2OH在Cu作催化剂条件下氧化生成E为CH3CHO,CH3CH2OH被酸性高锰酸钾氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成F为CH3COOCH2CH3,
(1)A是一种遇到碘单质能变蓝的多糖,A的名称是:淀粉,
故答案为:淀粉;
(2)反应①是葡萄糖在人体内发生氧化反应放出能量,其化学方程式为:C6H12O6+6O2→6CO2+6H2O,
故答案为:C6H12O6+6O2→6CO2+6H2O;
(3)C为CH3CH2OH,单质钠与C反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(4)C转化为E的反应为乙醇的催化氧化,反应的方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(5)B为葡萄糖,含有醛基、羟基,C为酒精,含有羟基,D为乙酸含有羧基,
A.新制Cu(OH)2,与葡萄糖反应有红色沉淀生成,与酒精物明显现象,与乙酸反应溶解,溶液呈蓝色,可以区别三种物质,故A正确;
B.NaOH溶液与乙酸反应,现象不明显,与葡萄糖、酒精互溶,无法区别,故B错误;
C.乙酸使石蕊试液显红色,石蕊试液与葡萄糖、酒精无明显现象,不能区别,故C错误;
D.Na2CO3溶液与乙酸反应生成二氧化碳,与葡萄糖、酒精无明显现象,可以区别出乙酸,不能区别葡萄糖与酒精,故D错误,
故答案为:A.
点评 本题考查有机物推断,涉及糖类、醇、羧酸性质与转化,注意掌握官能团的性质与转化,难度中等.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2?2SO3 △H=-196.6kJ/mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═2H2O(l)△H=-285.8kJ/mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6kJ•mol-1 | |
| D. | C(s)+O2(g)═CO2(g)△H=+395.9kJ/mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制Cu(OH)2悬浊液 | B. | 溴的CCl4溶液 | C. | 银氨溶液 | D. | KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.
储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠的化学式:NaCO3 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 硫原子的价电子排布式:3s23p4 | D. | 钠离子的结构示意图: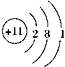 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的-OH含有的电子数为NA | |
| B. | 9.2 g甲苯分子中处于同一平面的原子数最多为1.3NA | |
| C. | 标准状况下,2.8 g乙烯分子中含有的单键数为0.5NA | |
| D. | 标准状况下,2.24 L戊烷所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
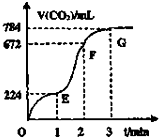 用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )
用纯净的CaCO3与100mL稀盐酸制取CO2实验过程记录如图(CO2的体积已折算成标准状态下的数值).下列分析错误的是( )| A. | 第1到第2分钟间混合物质质量减少最快 | |
| B. | EF段中,用盐酸表示该反应的平均速率为0.4mol•L-1•min-1 | |
| C. | OE、EF、FG三段中用CO2表示该反应的平均速率之比为2:4:1 | |
| D. | FG段溶液质量增加比EF段溶液质量增加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com