
有一份气体样品的质量是14.2 g,体积是4.48 L(标准状况下),该气体的摩尔质量是( )。
A.28.4 B.28.4 g/mol C.71 D.71 g/mol
D.71 g/mol
科目:高中化学 来源:2016-2017学年河北省卓越联盟高一上第一次月考化学试卷(解析版) 题型:选择题
由NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+的浓度为0.1mol/L,Mg2+的浓度为0.25mol/L,而Cl-为0.2mol/L,则SO42-的浓度是
A.0.2mol/L B.0.4mol/L C.0.3mol/L D.0.1mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省卓越联盟高二上第一次月考化学试卷(解析版) 题型:选择题
对于N2(g)+3H2(g) 2NH3(g),不能作为反应达到平衡状态的判断依据是( )
2NH3(g),不能作为反应达到平衡状态的判断依据是( )
A.恒容密闭容器中总压强不变
B.恒容密闭容器中混合气体的密度不变
C.生成氨气的速率与氨气分解的速率相等
D.N2、H2、NH3的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上10月月考化学试卷(解析版) 题型:填空题
19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为 ,该元素是(填元素符号) 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上10月月考化学试卷(解析版) 题型:选择题
粗盐中含可溶性CaCl2、MgCl2及Na2SO4,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是( )。
A. ①②③④ B. ②③①④ C. ②①③④ D. ①③②④
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第一次阶段考化学试卷(解析版) 题型:实验题
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式 。有同学认为Ⅱ中将盐酸换成硫酸和H2O2溶液更好,请结合离子方程式说明理由 。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过__________。废渣中的成分有_________________。
(4)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是_______________。
(5)某锂离子电池的总反应为C6+LiCoO2  LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第一次阶段考化学试卷(解析版) 题型:选择题
下列有关FeBr2溶液的叙述错误的是(NA代表阿伏加德罗常数的数值)( )
A.该溶液中Cu2+、NH4+、SO42-、Cl-可以大量共存
B.与硝酸酸化的AgNO3溶液反应有淡黄色沉淀生成并放出气体
C.向含有1 mol FeBr2的溶液中通入33.6 L Cl2,反应转移电子数目为3NA
D.向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:实验题
某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数。
甲方案:
实验步骤为:①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为B g;③加热;④冷却;⑤称量坩埚和残余物的质量为C g;⑥重复③至⑤操作,直至恒重,质量为D g。
(1)坩埚中发生反应的化学方程式 。
(2)计算Na2CO3质量分数必须用到的测定数据为 。
乙方案:
在天平上准确称取 0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mol·L-1的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3,即HCl+Na2CO3 == NaHCO3+NaCl。重复上述操作两次。
(3)配制上述盐酸标准溶液100ml,若用2.0mol/LHCl进行配制,需用量筒量取该HCl溶液 ml;定容时俯视刻度线,将导致配制的溶液浓度 。(填“偏高”、“偏低”或“没有影响”)
(4)根据下表数据,样品中w(Na2CO3)= 。(用百分数表示,保留一位小数)
滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 0.3000 | 1.02 | 21.03 |
2 | 0.3000 | 2.00 | 21.99 |
3 | 0.3000 | 0.20 | 20.20 |
丙方案:
称取m g样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
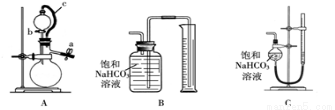
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气? (填“漏气”、“不漏气”或“无法确定”)。实验时,装置A中c的作用 , 。
(6)为了提高测定的准确性,应选用装置A和 (填写字母标号)进行实验。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列生产或实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | A、B两支试管,各加入4mL0.01mol/L的KMnO4酸性溶液,在A试管中加入2mL0.01mol/LH2C2O4溶液和在B试管中加入4mL 0.02mol/L的H2C2O4溶液,记录溶液褪色所需时间,B试管褪色时间短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com