
| A. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaY2和CaZ22种化合物中,阳离子与阴离子个数比均为1:2 |
分析 X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,3种元素的核外电子数之和为18;Z得到1个电子变成8电子结构,则Z为F元素;则X、Y一定至少有一种位于第2周期,X得到一个电子后均形成稀有气体原子的稳定电子层结构,则X为H元素,Y元素原子核外电子数为18-1-9=8,则Y为O元素,据此结合元素周期律的知识进行解答.
解答 解:X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,3种元素的核外电子数之和为18;Z得到1个电子变成8电子结构,则Z为F元素;则X、Y一定至少有一种位于第2周期,X得到一个电子后均形成稀有气体原子的稳定电子层结构,则X为H元素,Y元素原子核外电子数为18-1-9=8,则Y为O元素,
A.Z、X分别为F、H,二者形成的化合物weHF,HF分子之间含有氢键,沸点高于其它同族氢化物的沸点,故A正确;
B.X、Y、Z分别是H、O、F,同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径O>F>H,即Y>Z>X,故B错误;
C.CaY2为CaO2,过氧化钙与水反应中,过氧化钙既是氧化剂又是还原剂,故C错误;
D.CaZ2为CaF2,CaY2为CaO2,CaO2的阴离子为O22-,其阴、阳离子个数比为1:1,故D错误;
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素是解题关键,明确元素周期律内容、元素周期表结构为解答关键,C选项可根据过氧化钠的性质进行解答,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
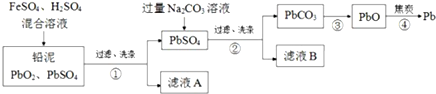
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BrCH2CH2CH2CH2CH2Br | B. | 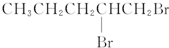 | ||
| C. | 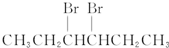 | D. | CH3CH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
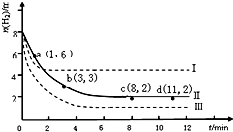
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190 | -70 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 |
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com