
 元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分: .
. ,用电子式表示羰基硫分子的形成过程为
,用电子式表示羰基硫分子的形成过程为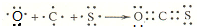 ,
,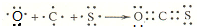 .
.


科目:高中化学 来源: 题型:
| A、NA个氧分子和NA个氢分子的质量比等于8:1 |
| B、11.2L H2中含有的原子数为NA个 |
| C、54g H2O中含有分子数为3NA个 |
| D、1mol/L Na2SO4溶液中离子数为3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 研究对象 | 平衡表达式 | 平衡类型 |
| A | CaCO3悬浊液 | CaCO3═Ca2++CO32- | 溶解平衡 |
| B | 新制的氯水 | Cl2+H2O═2H++Cl-+ClO- | 化学平衡 |
| C | 醋酸溶液 | CH3COOH+H2O═H3O++CH3COO- | 水解平衡 |
| D | CO2饱和溶液 | H2CO3═H++HCO3- | 电离平衡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁为负极,发生氧化反应 |
| B、可以选择碱性溶液作为电解质 |
| C、反应后正极和负极附近溶液的pH均升高 |
| D、正极的电极反应为:2MnO2+H2O+2e-═Mn2O3+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com