
| A. | Br2+2NaI═2NaBr+I2 | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | 2C+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑ | D. | 4Al+3MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$3Mn+2Al2O3 |
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
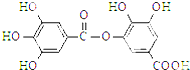
| A. | 能发生碱性水解,1 mol该有机物完全反应消耗8 mol NaOH | |
| B. | 常温下,能与Na2CO3溶液反应放出CO2 | |
| C. | 与稀硫酸共热,能生成两种有机物 | |
| D. | 该有机物的分子式为C14H10O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气含有的分子数目为nA | |
| B. | 1 mol H2所含有的电子数目为nA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 nA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
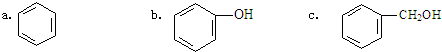
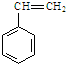 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.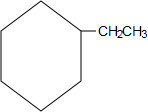 .
.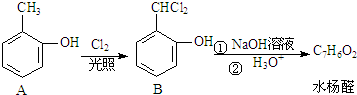
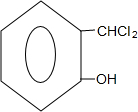 +2NaOH$→_{酸化}^{H_{2}O}$
+2NaOH$→_{酸化}^{H_{2}O}$ +2NaCl+H2O.
+2NaCl+H2O.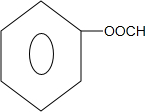 、
、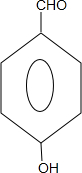 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
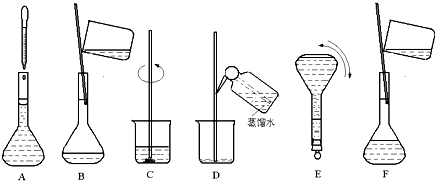
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
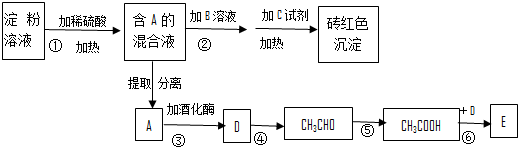
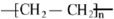 ,反应类型为加聚反应.
,反应类型为加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com