
.(17分)减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) 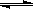 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。

①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性
明显增强。则该反应离子方程式为 。
②电化学降解NO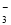 的原理如图所示,电源正极为 (填“a”或“b”);
的原理如图所示,电源正极为 (填“a”或“b”);
若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为 。
31.(17分)
(1)(4分)① C(s)+H2O(g) = CO(g) +H2(g) ΔH=+131.3kJ·mol-1 (2分)
② a c(2分,错1个0分)
(2)(5分)① 5:4(2分) ②KM=KN>KQ(3分。关系式正确1个给2分,全对3分)
(3)(8分)①2 NO3-+5H2催化剂N2+2OH-+4H2O(3分,化学式、系数、条件各1分)
②a(2分) 2 NO3-+12 H++10e-= N2↑+6H2O(3分。化学式、系数、条件各1分。阳极反应为:4OH-—4e-=O2↑+2H2O或10H2O-20e-=20H++5O2↑。)
【解析】
试题分析: (1)①根据盖斯定律,所求反应的热化学方程式可由已知方程式2-1得,因此焦炭与水蒸气的反应方程式为C(s)+H2O(g) = CO(g) +H2(g) ΔH=+131.3kJ·mol。
②洗涤含SO2的烟气是为了减少空气中SO2的排放,所以洗涤剂必须满足能够和SO2反应,所以选项中能够和SO2反应的试剂有Ca(OH)2 、Na2CO3 ,所以选ac。
(2) ①图中M、N两点平衡状态下,相应的转化率为70%、50%,因此根据反应情况计算
CO(g)+2H2(g) 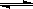 CH3OH(g)
CH3OH(g)
初始(mol):10 20 0
转化(mol):7 14 7
5 10 5
平衡(mol):3 6 7
5 10 5
n(M)总:n(N)总=(3+6+7):(5+10+5)=16:20=4:5
②平衡常数与温度有关,于压强无关,因此M、N2点的温度相同,平衡常数也相等,但是随着温度升高,由于正向CO的转化率下降,因此平衡逆向移动,平衡常数减小,因此有KM=KN>KQ 。
(3)①题中已经说的比较清楚,反应由H2将NO 还原为N2,且碱性增强,说明该反应是氧化还原反应,有OH-生成,根据氧化还原反应缺项配平,先把发生化合价变化的物质配平,然后原子守恒补上H2O,在电荷守恒配平得2 NO3-+5H2催化剂N2+2OH-+4H2O。
还原为N2,且碱性增强,说明该反应是氧化还原反应,有OH-生成,根据氧化还原反应缺项配平,先把发生化合价变化的物质配平,然后原子守恒补上H2O,在电荷守恒配平得2 NO3-+5H2催化剂N2+2OH-+4H2O。
②根据图中所示讲解的硝酸根被还原为了N2逸出,因此右边发生了还原反应,是阴极,b极为电源的负极,而a极是电源正极。根据总反应式,阴极发生的NO3-的还原反应为2 NO3-+12 H++10e-= N2↑+6H2O
考点:本题考查的是反应原理题目。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:2013-2014江苏宿迁市高一下学期期末测试化学试卷(解析版) 题型:选择题
下面有关氧化还原反应的叙述不正确的是 ( )
A.氧化还原反应的本质是电子的转移
B.在氧化还原反应中,失去电子的物质,一定有元素化合价升高
C.肯定有一种元素被氧化,另一种元素被还原
D.在反应中不一定所有元素的化合价都发生变化
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
下列有关叙述中,不可以用氢键来解释的是
A.0℃时,水的密度大于冰的密度 B.水的熔沸点高于硫化氢的熔沸点
C.氟化氢气体极易溶于水 D.氟化氢比氯化氢稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:实验题
(15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
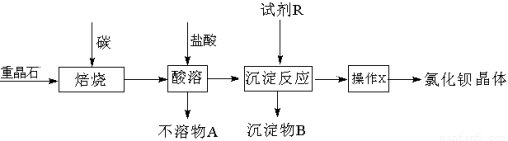
(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是 (填字母编号)。
a.用澄清石灰水吸收气体 b.用浓硫酸吸收气体 c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是 (写两个)。
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于 (填仪器名称)中冷却;④ ;⑤恒重操作。恒重操作的目的是 ;若最终测出的n值偏大,可能的实验操作误差原因是 (举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验: (用装置代号以“A
 ……
……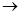 ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。

查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A、pH=1的溶液:Fe2+、NO3-、SO42-、Na+
B、c(H+)/c(OH-)=1012的溶液:NH4+、Al3+、NO3-、Cl-
C、c(Fe3+)=0.1 mol·L-1的溶液:K+、ClO-、SO42-、SCN-
D、水电离的c(H+)=l×10-14mol·L-1的溶液:Ca2+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014广东肇庆市毕业班第二次模拟考试理综化学试卷(解析版) 题型:选择题
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)= c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- )
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是( )
| A.①③⑤ | B.①②⑤ | C.①⑤⑥ | D.①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1 mol·L-1 NaOH溶液的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是( )
| A.溶液中可能含有AlO2- | B.溶液中可能含有NO3- |
| C.溶液中一定不含Fe2+和Fe3+ | D.溶液中可能含有Fe3+,但一定不含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com