
分析 (1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)醋酸与碳酸钙反应生成醋酸钙、二氧化碳气体和水,醋酸和碳酸钙都需要保留化学式;
(3)硫酸氢钠与氢氧化钠溶液反应生成硫酸钠和水,反应实质为氢离子与氢氧根离子反应生成水;
(4)碳酸氢铵与过量的氢氧化钠溶液加热反应生成氨气、碳酸钠和水;
(5)二氧化碳过量,二者反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:(1)金属铝与氢氧化钠溶液的反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)CH3COOH与碳酸钙都需要保留化学式,二者反应的离子方程式为:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑,
故答案为:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑;
(3)NaHSO4溶液与NaOH溶液反应生成硫酸钠和水,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(4)NH4HCO3溶液与过量NaOH溶液反应共热生成氨气、碳酸钠和水,反应的离子方程式为:NH4++HCO3-+2 OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,
故答案为:NH4++HCO3-+2 OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2 H2O+CO32-;
(5)向偏铝酸钠溶液中通过量CO2,反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查了离子方程式的书写,题目难度中等,根据反应物过量情况正确判断反应产物解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA | |
| D. | 此实验条件下,物质的氧化性:KMnO4>NaBiO3>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
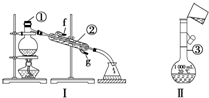 掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.
掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
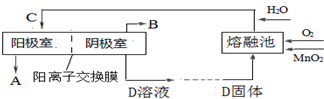
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 25℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2.5NA | |
| C. | 标准状况下,11.2 L H2O含有的原子数为1.5NA | |
| D. | 常温常压下,44 g CO2含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的原子 | |
| C. | 在任何情况下,1 mol CO2和64 g SO2所含有分子数和原子总数都相同 | |
| D. | 1 mol某气体的体积约为22.4 L,该气体所处的状况一定是标准状况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g H2O在标准状况下的体积是22.4L | |
| B. | 常温常压下,4g H2含有的分子数为 2NA | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液和NaAlO2溶液反应可以产生沉淀和气体,可以用作泡沫灭火器成分 | |
| B. | 侯德榜制碱过程涉及溶解度差异的原理,工业上从铝土矿制备较高纯度Al2O3的主要工艺流程中使用到CO2气体 | |
| C. | 一定条件下,Na、Mg、Fe都能和水反应生成对应的碱和氢气,Na2O2、MgO、Fe3O4都是碱性氧化物 | |
| D. | 纳米Fe、纳米Cu的化学活性都比原来增强,两者都能与盐酸反应生成氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com