
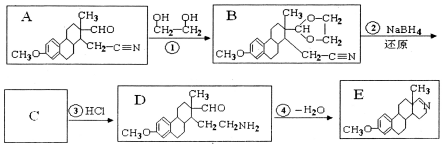
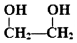 的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式
的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式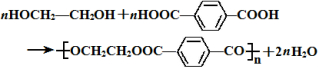 ;
;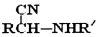 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$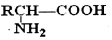
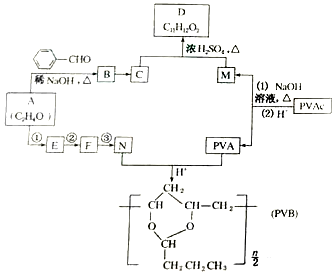
分析 (1)根据有机物的结构简式判断官能团;
(2)反应①涉及-CHO的加成,并形成C-O-键,可饱和醛基不被氧化;
(3)根据D的结构简式,其含有苯环、醛基、氨基来判断;
(4)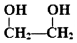 为乙二醇;对苯二甲酸发生缩聚反应生成高聚物;
为乙二醇;对苯二甲酸发生缩聚反应生成高聚物;
(5)CH3CHO和CH3NH2反应生CH3CH=NCH3,然后与HCN发生加成反应生成CH3C(CN)-NHCH3,然后在酸性条件下可生成目标物,以此解答该题.
解答 解:(1)由结构简式可知A含有醛基、醚键,故答案为:醛基、醚键;
(2)反应①涉及-CHO的加成,并形成C-O-键,同时发生取代反应,醛基在有机合成中易被氧化和还原,故应先保护,而后释放出来,防止被氧化,
故答案为:加成反应;取代反应;保护醛基;
(3)a.因为含有苯环、醛基,所以1mol D最多可与4mol H2发生加成反应,故a错误;
b.含有氨基,可以与盐酸发生反应,故b正确;
c.含有醛基,可被高锰酸钾氧化,可以使高锰酸钾酸性溶液褪色,故c正确;
d.含有O、N等元素,为烃的衍生物,故d错误.
故选ad;
(4)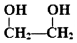 为乙二醇;对苯二甲酸发生缩聚反应生成高聚物,方程式为
为乙二醇;对苯二甲酸发生缩聚反应生成高聚物,方程式为 ,
,
故答案为:乙二醇; ;
;
(5)CH3CHO和CH3NH2反应生CH3CH=NCH3,然后与HCN发生加成反应生成CH3C(CN)-NHCH3,然后在酸性条件下可生成目标物,反应流程为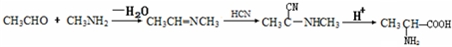 ,
,
故答案为: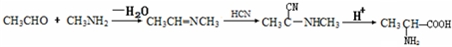 .
.
点评 本题考查有机物的合成,为高频考点,侧重考查学生的分析能力,题目难度中等,解答本题的关键是根据官能团的结构、性质以及物质之间反应的官能团的转化判断可能发生的反应类型,准确把握题给信息.


科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 6.6 | 5.2 | 4.4 |
| 沉淀完全时的pH | 3.7 | 8.9 | 8.1 | 5.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;
,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
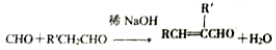 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)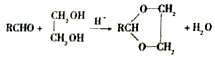
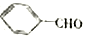 合成B的化学方程式是
合成B的化学方程式是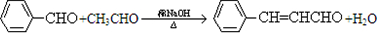 .
.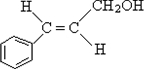 .
.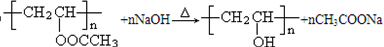 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 起始(mL) | 终点(mL) | |
| 1 | 5.00 | 20.02 |
| 2 | 3.00 | 18.00 |
| 3 | 4.00 | 18.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com