
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g CO2含有的原子数目为 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100mL12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18mL 水含有的分子数目约为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
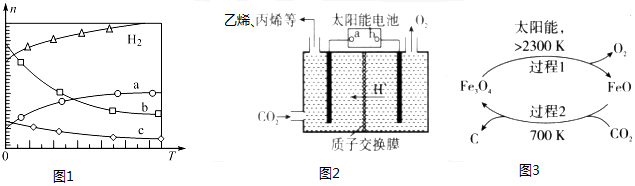
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
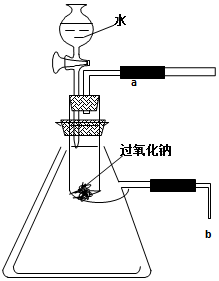 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫易溶于水 | B. | 用CCl4 萃取碘水中的碘 | ||
| C. | 氯气易溶于NaOH溶液 | D. | 苯与水混合静置后分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼分子间含有氢键 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈正三角形,属非极性分子 | |
| D. | 其分子空间结构类似CH4O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com