
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应,转化关系中有些反应的产物和反应的条件没有全部标出。
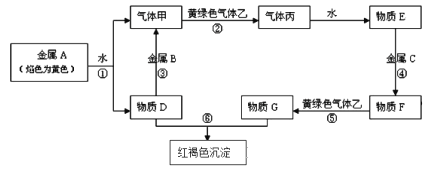
请根据以上信息回答下列问题:
(1)写出金属元素A在周期表中的位置:____________,物质D的电子式:____________。
(2)写出下列反应的离子方程式:反应③__________________________________;
反应⑤_______________________________________。
(3)检验物质G中阳离子的操作方法 ________________________________________。
(4)实验室制取黄绿色气体乙的化学方程式为 _________________________________,在该反应中如有0.5mol乙生成,转移电子的物质的量是______mol,制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为 ______________________________________。
【答案】 第三周期第ⅠA族 ![]() 2Al+2OH-+2H2O2AlO2-+3H2↑ 2Fe2++Cl2
2Al+2OH-+2H2O2AlO2-+3H2↑ 2Fe2++Cl2![]() 2Fe3++2Cl- 取物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色或红色,证明物质G中有Fe3+离子 MnO2+4HCl(浓)
2Fe3++2Cl- 取物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色或红色,证明物质G中有Fe3+离子 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1 Cl2+2OH-
MnCl2+Cl2↑+2H2O 1 Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
【解析】根据转化关系中突出的信息可知,金属A焰色呈黄色,即为Na,黄绿色气体乙为Cl2,Na与水反应生成气体甲为H2,物质D为NaOH,能与NaOH溶液反应生成H2的金属B为Al,H2与Cl2反应生成气体丙为HCl,溶于水得E为盐酸,根据红褐色沉淀说明G为FeCl3,则F为FeCl2,金属C为Fe。
(1)金属钠在周期表中的位置是第三周期第ⅠA族;NaOH的电子式为![]() 。
。
(2)反应③的离子方程式为2Al+2OH-+2H2O2AlO2-+3H2↑,反应⑤的离子方程式为2Fe2++Cl22Fe3++2Cl-;
(3)检验Fe3+的操作方法是取物质G的溶液少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色,即证明物质G中有Fe3+离子;
(4)实验室制取Cl2的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;若生成0.5molCl2,则转移电子的物质的量为1mol;反应后多余的Cl2可用NaOH溶液吸收,以防止污染环境,反应的离子方程式为Cl2+2OH-Cl-+ClO-+H2O。
MnCl2+Cl2↑+2H2O;若生成0.5molCl2,则转移电子的物质的量为1mol;反应后多余的Cl2可用NaOH溶液吸收,以防止污染环境,反应的离子方程式为Cl2+2OH-Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】(1)在2L恒容密闭容器中,发生反应2NO(g)+O2(g)2NO2(g).
①某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0~4s内以O2浓度变化表示的反应速率为________.
②能说明该反应已达到平衡状态的是________.
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ正(NO)=2υ正(O2) D.气体压强保持不变
③已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是_______.
A、升高温度 B、充入Ar使压强增大
C、选择高效催化剂 D、充入NO使压强增大
(2)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml 1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:____________________________________________.
②电解后溶液的pH=________(忽略氯气与氢氧化钠溶液反应).
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题:

①下列3个反应中符合示意图描述的反应的是 ___________(填代号).
A、铝粉与Fe2O3反应 B、用水稀释浓硫酸溶液 C、灼热的碳与CO2反应
②以甲烷为原料制取氢气是工业上常用的制氢方法.已知:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+306kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+240kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把等量金属钠进行下列实验,其中生成氢气最多的是
A.把钠放入足量稀盐酸中B.把钠放入足量水中
C.把钠放入硫酸铜溶液中D.将钠用铝箔包好并刺些小孔,再放入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用废弃的铁铝混合物(含Fe、Al、Al2O3、Fe2O3)回收金属铝和铁,实验流程设计如下:
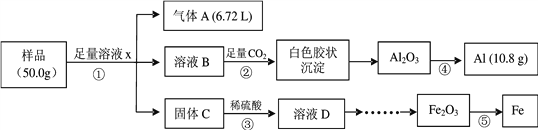
(1)写出①中发生反应的离子方程式___________、_____________。
(2)下列说法正确的是_________。
a. ②中发生的是非氧化还原反应
b. ③中所得溶液D中含有Fe2+和Fe3+
c. ④和⑤分别采用电解法和热还原法
(3)由溶液D制取Fe2O3的实验过程是 ______________。
(4)该样品中Al2O3的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
软锰矿还原浸出的反应为:12MnO2+ C6H12O6+ 12H2SO4=12MnSO4+ CO2↑+18H2O
①该反应中,还原剂为__________。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_____________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq)![]() Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)Fe(s)+CO2(g)△H>0
试回答下列问题:
(1)写出该反应的平衡常数表达式 .
(2)升高温度,该反应的平衡常数K值将(填“增大”、“减小”、“不变”),平衡体系中固体的质量将( 填“增大”、“减小”、“不变”).
(3)已知1100℃时该反应的平衡常数K=0.263.在该温度测得高炉中c(CO2)=0.025molL﹣1 , c(CO)=0.1molL﹣1 , 此时该的化学反应速度是v(正) (填“>”、“<”、“=”)v(逆).
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值(填”>”、“<”、“=”)0.263.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁片和碳棒按图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装罝的说法,正确的是( )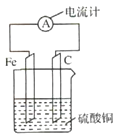
A.碳棒是正极
B.该装置能将电能转化为化学能
C.外电路中电流由铁片流出经过电流计流向碳棒
D.该装置的总反应为:2Fe+3Cu2+=2Fe3++3Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊(81T1)是元素周期表ⅢA族元素,下列关于铊的叙述不正确的是( )
A.铊比铝的金属性更强
B.氢氧化铊一定具有两性
C.铊在化合物中可以是+3价
D.铊能与盐酸反应放出氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com