
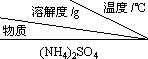
 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |


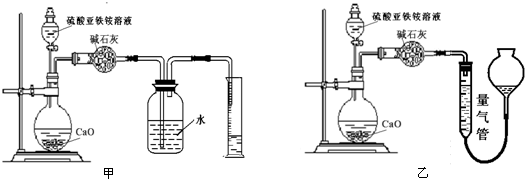
分析 Ⅰ.(1)水浴加热便于控制温度;亚铁离子易被氧化,少量铁还原氧化生成的Fe3+;FeSO4在温度低时溶解度较小;
(2)从滤液到得到晶体需要加热浓缩、冷却结晶、过滤、洗涤干燥等过程;
(3)乙醇易挥发,少量酒精来洗去晶体表面杂质;
Ⅱ.(1)亚铁离子具有还原性,易被氧化;检验亚铁离子的氧化产物铁离子;
(2)①根据氨气的溶解性和装置特点分析;
②根据氨气的体积计算氨气的物质的量,根据N守恒计算出硫酸亚铁铵的质量,进而计算质量分数.
解答 解:Ⅰ.(1)步骤二实验需要温度为:70~75℃,采用水浴加热便于控制温度;亚铁离子易被氧化,少量铁可还原氧化生成的Fe3+,减少产物中的Fe3+杂质,如果不趁热过滤就会有FeSO4•7H2O析出;
故答案为:水浴加热;防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出;
(2)从滤液到得到晶体需要加热浓缩、冷却结晶、过滤、洗涤干燥等过程,故答案为:加热浓缩、冷却结晶;
(3)乙醇易挥发,用少量酒精来洗去晶体表面杂质,用水会使摩尔盐溶解损失,用滤液会带入杂质,故答案为:b;
Ⅱ.(1)亚铁离子具有还原性,易被氧化成铁离子,故测得硫酸亚铁铵浓度偏小;可检验亚铁离子的氧化产物铁离子,具体操作为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
故答案为:Fe2+已被空气部分氧化;取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(2)①氨气易溶于水,不能用排水法收集,甲装置中导管伸入液面下,易倒吸,用排水法,不合理;乙装置中导管在液面以上,符合排液体收集气体要求,量气管中液体应不能溶解氨气,氨气易溶于水和饱和碳酸钠溶液,难溶于四氯化碳,故用排四氯化碳法收集;
故答案为:乙;甲装置会出现倒吸;c;
②VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
m g硫酸亚铁铵样品中含N的物质的量为 $\frac{500ml}{20ml}$mol=$\frac{25V}{22.4}$mol,
硫酸亚铁铵的纯度为:$\frac{\frac{25V}{22.4}×\frac{1}{2}mol×392g/mol}{mg}$×100%=$\frac{392V×25}{44.8m}$×100%,
故答案为:$\frac{392V×25}{44.8m}$×100%.
点评 本题考查制备实验方案的设计,综合性较强,注意结合题给信息和装置特点及物质的性质分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,加水稀释后,n(H+)•n(OH-)的乘积不变 | |
| B. | 离子浓度关系:3c(Fe3+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-) | |
| C. | 溶液呈酸性是因为NH4++H2O?NH3H2O+H+ | |
| D. | 温度升高(假设溶液的体积没有变化)溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
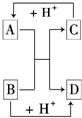 已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.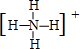 ,D的电子式
,D的电子式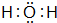 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白、红、白、蓝 | B. | 白、白、白、蓝 | C. | 白、黑、白、蓝 | D. | 红、黑、红、蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键,可能含共价键,共价化合物中只含共价键绝不含有离子键 | |
| B. | 单质分子中均存在化学键,且只含有共价键,不可能含有离子键 | |
| C. | 共价化合物中可能含非极性共价键,离子化物中不可能含非极性共价键 | |
| D. | 共价化合物中可能含离子键,离子化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式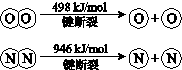
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com