
| A. | BeCl2 | B. | NH3 | C. | BF3 | D. | H2O |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时,温度计的水银球必须插入液面下 | |
| B. | 用浓氨水洗涤做过银镜反应的试管 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加直至沉淀刚好溶解为止 | |
| D. | 蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于同一主族的元素的价电子数相同,则各元素的常见化合价也一定相同 | |
| B. | 碱金属族元素同卤族元素一样,其单质的熔沸点随元素原子序数的增大而逐渐升高 | |
| C. | 若x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是ⅢA族 | |
| D. | 在周期表中金属和非金属元素的分界线附近的元素是过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
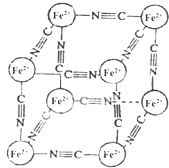 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中既有离子键又有极性共价键 | |
| B. | 晶体的化学式可表示为[M2Fe(CN)3] | |
| C. | M+离子位于晶胞体心 | |
| D. | 与每个Fe2+距离相等且最近的CN-有6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com