
【题目】Fe3O4呈黑色、有磁性,应用广泛。以Fe3O4为吸附剂去除水中含磷物质是一种新的除磷措施。
(1)检验Fe3O4中铁元素的价态:用盐酸溶解Fe3O4,取少量滴加______,溶液变红;另取少量滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。
(2)氧化—沉淀法制备Fe3O4
Ⅰ.向稀硫酸中加入过量铁粉,得到FeSO4溶液。空气中存在O2,由于_______(用离子方程式表示),可产生Fe3+。过量铁粉的作用是除去Fe3+。
Ⅱ.在N2保护下,向热NaOH溶液中加入FeSO4溶液,搅拌,得到Fe(OH)2浊液。将NaNO3溶液滴入浊液中,充分反应得到Fe3O4。
①用湿润红色石蕊试纸检验产物,_______(填现象),证明生成了NH3。
②____Fe(OH)2+_____NO3-=________(将反应补充完整)。
(3)含磷各微粒在溶液中的物质的量分数与pH的关系如下图所示。

下列分析正确的是________。
a.KH2PO4的水溶液中:c(H+)>c(OH-)
b.K2HPO4 溶液显碱性,原因是HPO42-的水解程度大于其电离程度
c.H3PO4是强电解质,在溶液中完全电离
(4)将Fe3O4加到KH2PO4溶液中,调节溶液pH。pH对吸附剂Fe3O4表面所带电荷的影响:pH<6.8,Fe3O4表面带正电荷;pH>6.8,Fe3O4表面带负电荷;pH=6.8,Fe3O4表面不带电荷。Fe3O4对含磷微粒的去除率随pH的变化如下。

①pH=3时,吸附的主要微粒是_______。
②与pH=5时相比,pH=9时的去除率明显下降,原因是:_________。
【答案】KSCN溶液 4Fe2++4H++O2=4Fe3++2H2O 试纸变蓝 12 1 4Fe3O4+NH3↑+OH-+10H2O ab H2PO4- pH=5时,Fe3O4带正电荷,含磷的主要微粒是H2PO4-;pH=9时,Fe3O4带负电荷,含磷的主要微粒是HPO42-。因此在pH=9时,吸附剂和含磷的主要微粒之间的静电排斥作用强于pH =5时
【解析】
(1) Fe3O4与HCl反应产生FeCl2、FeCl3,向溶液中加入KSCN溶液,溶液变为血红色,证明含有Fe3+;向溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,证明含有Fe2+;
(2)I.空气中的氧气与溶液中的Fe2+会发生氧化还原反应,4Fe2++4H++O2=4Fe3++2H2O,产生Fe3+;若加入Fe粉,就会发生2Fe3++Fe=3Fe2+,从而可除去Fe3+,防止溶液变质;
II.①氨气的水溶液显碱性,能够使湿润的红色石蕊试纸变为蓝色;
②Fe(OH)2被NO3-氧化为Fe3O4,NO3-被还原为NH3,根据电子守恒,可知Fe(OH)2的系数是12,Fe3O4的系数是4,NO3-、NH3的系数是1,根据电荷守恒可知生成物中还有OH-,根据元素守恒,可知生成物还有H2O,系数是10,所以配平的方程式为12Fe(OH)2+NO3-= 4Fe3O4+NH3+OH-+10H2O;
(3) a.根据图示可知H2PO4-存在的pH<5,溶液显酸性,所以KH2PO4的水溶液中:c(H+)>c(OH-),a正确;
b.K2HPO4是三元弱酸的酸式盐,在溶液中HPO42-既存在电离作用,也存在水解作用。电离产生H+使溶液显酸性;水解消耗水电离产生的H+,当最终达到平衡时溶液中c(OH-)>c(H+),使溶液又显碱性。现在K2HPO4溶液显碱性,说明HPO42-的水解程度大于其电离程度,溶液中c(OH-)>c(H+),b正确;
c.由于溶液的pH不同,溶液中磷元素的主要存在的微粒种类不同,说明H3PO4是弱电解质,在溶液中存在电离平衡,不能完全电离,c错误;
故合理选项是ab;
(4)①根据pH对吸附剂Fe3O4表面所带电荷的影响:pH<6.8,溶液中主要存在微粒是H2PO4-;Fe3O4表面带正电荷,现在溶液的pH=3,所以Fe3O4吸附的就是正电荷,主要微粒是H2PO4-;
②pH=9时,Fe3O4带负电荷,含磷的主要微粒是HPO42-。因此在pH=9时,吸附剂和含磷的主要微粒之间的静电排斥作用强于pH =5时。


科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O。

(1)甲池是______装置;
(2)乙池中A(石墨)电极的名称是______;
(3)写出通入CH3OH的电极的电极反应式:______;
(4)乙池中反应的化学方程式为______;
(5)当乙池中B(Ag)极的质量增加4.32g时,此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是 ______(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)漂白粉溶液在空气中放置失效,发生反应的离子方程式:_______________________。
(2)次氯酸的电离方程式:______________________________________。
(3)氯化铁溶液与单质铜反应的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
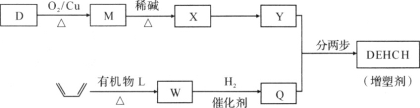
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“空气吹出法”从海水中提取溴的工艺流程如下:

下列说法不正确的是
A. 蒸馏塔中只发生了物理变化
B. 吸收塔利用了SO2的还原性,使Br2还原成Br-
C. 在吸收塔中溴元素得到了富集
D. 吹出塔中通入水蒸气,能减小Br2的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载,小米“健脾、和胃、安眠”,这主要是某种氨基酸的作用。下列有机物水解能生成氨基酸的是( )
A.蔗糖B.蛋白质C.油脂D.纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)最大的是________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度最大的是________。
(3)将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是_________。
(4)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,(写出计算式,不必计算最终结果)。温度升高,Ka将______(填“变大”、“不变”或“变小”)。
(5)在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com