
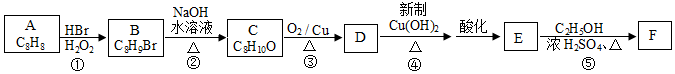
 .
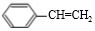
.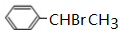 .
.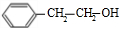 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2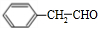 +2H2O、
+2H2O、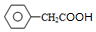 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$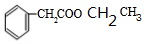 +H2O.
+H2O.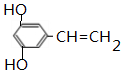 .
. 制备
制备 的合成路线.
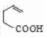
的合成路线. 分析 A的不饱和度=$\frac{8×2+2-8}{2}$=5,A是一种能与溴水反应的使其褪色的芳香烃,A中含有碳碳双键,则A结构简式为 ,A和HBr反应生成B,根据B分子式知,该反应为加成反应;B发生取代反应生成醇C,C能连续被氧化,则说明B中Br原子位于边上,则B结构简式为
,A和HBr反应生成B,根据B分子式知,该反应为加成反应;B发生取代反应生成醇C,C能连续被氧化,则说明B中Br原子位于边上,则B结构简式为 ,C结构简式为
,C结构简式为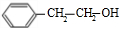 ,C被氧化生成D为
,C被氧化生成D为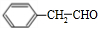 ,D被氧化然后酸化后生成的E为
,D被氧化然后酸化后生成的E为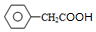 ,E和甲醇发生酯化反应生成F为
,E和甲醇发生酯化反应生成F为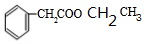 ;
;
(6) 和HBr在H2O2作用下发生加成反应生成HOOCCH2CH2CH2CH2Br,HOOCCH2CH2CH2CH2Br发生水解反应然后酸化生成HOOCCH2CH2CH2CH2OH,HOOCCH2CH2CH2CH2OH发生酯化反应生成
和HBr在H2O2作用下发生加成反应生成HOOCCH2CH2CH2CH2Br,HOOCCH2CH2CH2CH2Br发生水解反应然后酸化生成HOOCCH2CH2CH2CH2OH,HOOCCH2CH2CH2CH2OH发生酯化反应生成 .
.
解答 解:A的不饱和度=$\frac{8×2+2-8}{2}$=5,A是一种能与溴水反应的使其褪色的芳香烃,A中含有碳碳双键,则A结构简式为 ,A和HBr反应生成B,根据B分子式知,该反应为加成反应;B发生取代反应生成醇C,C能连续被氧化,则说明B中Br原子位于边上,则B结构简式为
,A和HBr反应生成B,根据B分子式知,该反应为加成反应;B发生取代反应生成醇C,C能连续被氧化,则说明B中Br原子位于边上,则B结构简式为 ,C结构简式为
,C结构简式为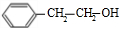 ,C被氧化生成D为
,C被氧化生成D为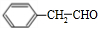 ,D被氧化然后酸化后生成的E为
,D被氧化然后酸化后生成的E为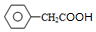 ,E和甲醇发生酯化反应生成F为
,E和甲醇发生酯化反应生成F为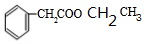 ;
;
(1)通过以上分析知,A结构简式为 ,故答案为:
,故答案为: ;
;
(2)通过以上分析知,①是加成反应、②是取代反应、③是氧化反应、④是氧化反应、⑤是取代反应,所以在上述合成路线发生的反应中属于取代反应的是②⑤,
故答案为:②⑤;
(3)反应①发生时若不加入H2O2,会生成较多的一种副产物,这种副产物的结构简式为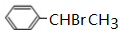 ,
,
故答案为: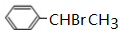 ;
;
(4)C结构简式为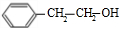 ,C被氧化生成D为
,C被氧化生成D为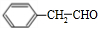 ,反应方程式为
,反应方程式为
2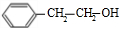 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2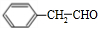 +2H2O,
+2H2O,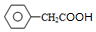 和甲醇发生酯化反应生成F为
和甲醇发生酯化反应生成F为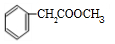 ,
,
反应方程式为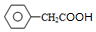 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$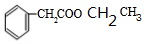 +H2O,
+H2O,
故答案为:2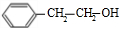 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2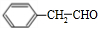 +2H2O;
+2H2O;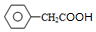 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$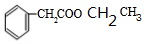 +H2O;
+H2O;
(5)E为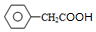 ,在化合物E多种同分异构体中,只含有一种含氧官能团,且能与FeCl3溶液发生显色反应,说明含有两个酚羟基,根据其结构简式知,还含有一个碳碳双键,如果两个羟基位于邻位,有2种同分异构体,如果两个羟基位于间位,有3种同分异构体,如果两个酚羟基位于对位有1种同分异构体,则符合条件的有6种结构;
,在化合物E多种同分异构体中,只含有一种含氧官能团,且能与FeCl3溶液发生显色反应,说明含有两个酚羟基,根据其结构简式知,还含有一个碳碳双键,如果两个羟基位于邻位,有2种同分异构体,如果两个羟基位于间位,有3种同分异构体,如果两个酚羟基位于对位有1种同分异构体,则符合条件的有6种结构;
任写一种满足上述条件且核磁共振氢谱中有5个峰信号的同分异构体的结构简式 ,
,
故答案为:6; ;
;
(6) 和HBr在H2O2作用下发生加成反应生成HOOCCH2CH2CH2CH2Br,HOOCCH2CH2CH2CH2Br发生水解反应然后酸化生成HOOCCH2CH2CH2CH2OH,HOOCCH2CH2CH2CH2OH发生酯化反应生成
和HBr在H2O2作用下发生加成反应生成HOOCCH2CH2CH2CH2Br,HOOCCH2CH2CH2CH2Br发生水解反应然后酸化生成HOOCCH2CH2CH2CH2OH,HOOCCH2CH2CH2CH2OH发生酯化反应生成 ,其合成路线为
,其合成路线为 $→_{H_{2}O_{2}}^{HBr}$HOOCCH2CH2CH2CH2Br$→_{△}^{NaOH}$$\stackrel{酸化}{→}$HOOCCH2CH2CH2CH2OH$→_{△}^{浓硫酸}$
$→_{H_{2}O_{2}}^{HBr}$HOOCCH2CH2CH2CH2Br$→_{△}^{NaOH}$$\stackrel{酸化}{→}$HOOCCH2CH2CH2CH2OH$→_{△}^{浓硫酸}$ ,故答案为:
,故答案为: $→_{H_{2}O_{2}}^{HBr}$HOOCCH2CH2CH2CH2Br$→_{△}^{NaOH}$$\stackrel{酸化}{→}$HOOCCH2CH2CH2CH2OH$→_{△}^{浓硫酸}$
$→_{H_{2}O_{2}}^{HBr}$HOOCCH2CH2CH2CH2Br$→_{△}^{NaOH}$$\stackrel{酸化}{→}$HOOCCH2CH2CH2CH2OH$→_{△}^{浓硫酸}$ .
.
点评 本题考查有机物推断及有机合成,为高频考点,侧重考查学生分析、推断、知识迁移及知识综合运用能力,明确官能团的性质及物质之间的转化、反应条件是解本题关键,注意:烯烃和HBr发生加成反应的产物与反应条件有关,难点是同分异构体种类判断,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol | B. | 0.50mol | C. | 0.60mol | D. | 0.70mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
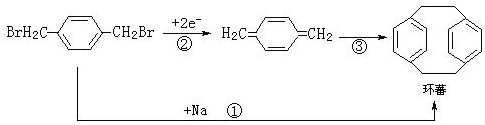
| A. | 反应①属于水解反应 | |
| B. | 反应③属于加成反应 | |
| C. | 环蕃所有的碳原子一定在同一个平面上 | |
| D. | 环蕃的核磁共振氢谱有3组峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
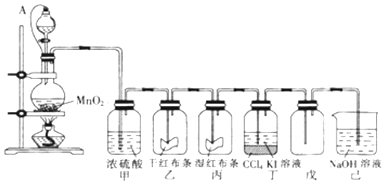
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡 所需时间/s | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol•L-1•s-1 | |
| D. | 容器Ⅲ中平衡后,等温条件下充入一定量He,平衡不发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
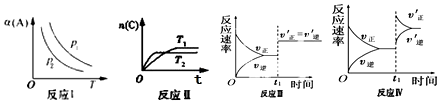
| A. | 反应 I:若 p1>p2,则 a+b<c | |
| B. | 反应Ⅱ:此反应的△H<0,且 T1<T2 | |
| C. | 反应Ⅲ:表示t1 时刻一定是使用催化剂对反应速率的影响 | |
| D. | 反应Ⅳ:表示t1时刻增大 B 的浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的常用方法有蒸馏法、离子交换法和电解法 | |
| B. | 钢铁在焊接前可以用NH4C1溶液的酸性清除表面的铁锈 | |
| C. | 甲醛和苯酚通过加聚反应制得酚醛树脂 | |
| D. | 在轮船外壳上焊接锌块或接直流电源正极,均可减缓船体的腐蚀速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com