
分析 (1)25℃时,等体积、等浓度的HA和氢氧化钠恰好反应生成盐,测定混合溶液的pH>7,说明该溶液呈碱性,则该盐是强碱弱酸盐,酸根离子易水解;
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(3)根据元素守恒[HA]+[A-]=[Na+]进行计算;
(4)根据(1)的分析可知,该盐为强酸弱碱盐,溶液呈碱性,据此判断.
解答 解:(1)25℃时,等体积、等浓度的HA和氢氧化钠恰好反应生成盐,测定混合溶液的pH>7,说明该溶液呈碱性,则该盐是强碱弱酸盐,酸根离子易水解,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,水解离子方程式为:A-+H2O?HA+OH-,
故答案为:A-+H2O?HA+OH-;
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离,NaA是含有弱根离子的盐,氢氧化钠是强碱,所以NaA促进水电离,氢氧化钠抑制水电离,则混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+),
故答案为:>;
(3)0.1mol/LHA溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中[Na+]=0.05mol/L,根据元素守恒[HA]+[A-]=[Na+]=0.05mol/L,
故答案为:0.05;
(4)根据(1)的分析可知,该盐为强酸弱碱盐,溶液呈碱性,所以微粒浓度的由大到小顺序为[Na+][A-][OH-][HA][H+]或者[Na+][A-][OH-][H+][HA],
故答案为:[Na+][A-][OH-][HA][H+]或者[Na+][A-][OH-][H+][HA].
点评 本题考查酸碱混合溶液离子浓度的有关计算,明确盐类水解原理、应用电荷守恒来分析解答即可,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [HCN]<[CN-] | B. | [Na+]<[CN-] | ||
| C. | [HCN]-[CN-]=[OH-] | D. | [HCN]+[CN-]=0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3>H2O>HF | |
| C. | 密度大小:Rb>K>Na>Li | |
| D. | 等物质的量浓度溶液,酸性强弱顺序:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+) | |
| B. | 稀释前,c(ROH)=10c(MOH) | |
| C. | 稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 | |
| D. | 等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
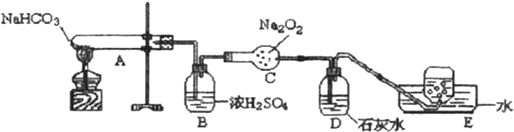
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | 氧化铁呈红棕色 | 红色涂料 |
| B | 氧化铝熔点很高 | 耐火材料 |
| C | 浓硫酸具有脱水性 | 干燥剂 |
| D | 液氨汽化时要吸收大量的热 | 制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 晶体中碳原子键全部是碳碳单键 | |
| B. | 石墨烯与金刚石都是碳的同素异形体 | |
| C. | 石墨烯中所有碳原子可以处于同一个平面 | |
| D. | 从石墨中剥离得到石墨烯需克服分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com