
| A. | 金刚石燃烧比石墨燃烧放出的热量少 | |
| B. | 等质量是石墨燃烧放热多 | |
| C. | 石墨的能量比金刚石的能量高 | |
| D. | 由石墨制备金刚石一定是吸热反应 |
分析 由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(石墨)=C(金刚石);△H=+1.9kJ•mol-1,根据反应热比较金刚石与石墨的能量大小,以此解答该题.
解答 解:由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1,
利用盖斯定律将①-②可得:C(石墨)=C(金刚石);△H=+1.9kJ•mol-1,则石墨转化为金刚石吸热,金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,等质量时金刚石燃烧放热多,
故选D.
点评 本题考查热化学方程式的书写及应用,为高频考点,侧重考查学生的分析能力,题目难度不大,注意物质的稳定性与能量的关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 它们都含有碳、而且碳原子有四个价电子,碳原子间以及碳与其他原子间结构多样 | |
| B. | 它们反应很复杂 | |
| C. | 制取它们的方法很多 | |
| D. | 它们都是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
| A. | 当容器中气体的压强保持不变时,说明该反应已达平衡 | |
| B. | 0~20min内,以CO表示的平均反应速率为0.0125mol•L-1•min-1 | |
| C. | 该温度下平衡常数K的数值为16 | |
| D. | 升高温度,K值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①的平衡常数K1=$\frac{c(C{O}_{2})•c(Cu)}{c(CO)•c(CuO)}$ | |
| B. | 反应③的平衡常数K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 | |
| D. | 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | 2 |
| Ⅱ | 320 | 0.80 | t1 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,容器Ⅱ中PCl5的转化率小于25% | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.05mol•L-1•s-1 | |
| D. | 起始时向容器Ⅲ中充入0.30molPCl5、0.45molPCl3和0.10molCl2,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3molH2+1molN2 | B. | 2molNH3+1molN2 | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
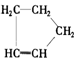 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 .环戊烯的化学性质跟烯烃相似.
.环戊烯的化学性质跟烯烃相似.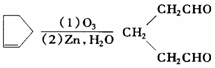
 )臭氧分解各种产物的结构简式及物质的量之比:HCHO、
)臭氧分解各种产物的结构简式及物质的量之比:HCHO、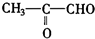 ;2:1.
;2:1.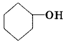 )合成乙二醛(
)合成乙二醛( 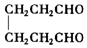 )的各步合成路线流程.
)的各步合成路线流程.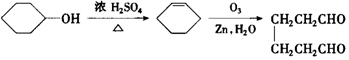 .
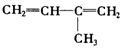
.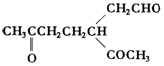 .A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).
.A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).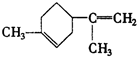 ,B是
,B是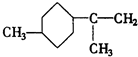 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com