
 ;
; ;
; ;
; ;
; ;
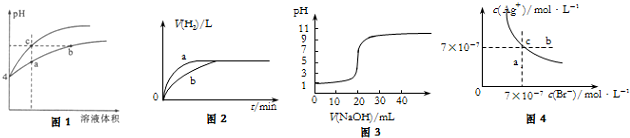
;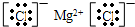 ;
;分析 (1)NH4Cl是离子化合物,由铵根离子和氯离子构成;
(2)Na2O是离子化合物,由Na+离子和O22-离子构成;
(3)Na2O2是离子化合物,由Na+离子和O2-离子构成;
(4)H2S是通过共用电子对形成的共价化合物;
(5)二氧化碳中存在两对碳氧共用电子对;
(6)氯化镁为离子化合物,必须标出阴阳离子的电子式;
仅含离子键的是氧化钠、氯化镁;仅含共价键的是硫化氢、二氧化碳;既有离子键又有共价键的是氯化铵、过氧化钠.
解答 解:(1)氯化铵为离子化合物,电子式为: ,故答案为:
,故答案为: ;
;
(2)氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: ,
,
故答案为: ;
;
(3)Na2O2是离子化合物,由Na+离子和O22-离子构成,Na2O2的电子式为: ,故答案为:
,故答案为: ;
;
(4)硫化氢中硫原子与2个氢原子共用2对电子对,电子式为  ,故答案为:
,故答案为: ;
;
(5)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故答案为:
,故答案为: ;
;
(6)氯化镁为离子化合物,电子式为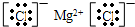 ,故答案为:
,故答案为: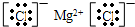 ;
;
仅含离子键的是氧化钠、氯化镁;仅含共价键的是硫化氢、二氧化碳;既有离子键又有共价键的是氯化铵、过氧化钠,故答案为:(2)、(6);(4)、(5);(1)、(3).
点评 本题考查电子式的书写,题目难度不大,注意掌握电子式的书写方法:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 在化学反应中,M原子既不容易失去电子,又不容易得到电子 | |
| B. | 等物质的量的X、Y的单质与足量盐酸反应,生成的氢气一样多 | |
| C. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 | |
| D. | Z的氢化物的稳定性强于L的氢化物的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C3H6 | C. | C2H6 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=A+n | D. | 所含质子数=A+Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 图1某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH 变化曲线,用等浓度NaOH溶液分别和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc | |
| B. | 图2中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)与同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. | 图3表示25℃用0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1 CH3COOH溶液得到的滴定曲线 | |
| D. | 图4表示某温度下AgBr在水中的沉淀溶解平衡曲线的图象,向AgBr的饱和溶液中加入NaBr固体,可以使溶液由c点到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com