
| A. | AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 | |
| B. | KSP(AgCl)>KSP(Ag2CrO4),可说明Ag2CrO4比AgCl难溶于水 | |
| C. | 将0.00lmol•L-1AgNO3溶液滴入0.001 mol•L-1KC1和0.00lmol•L-1K2CrO4混合溶液中,先产生Ag2CrO4沉淀 | |
| D. | 同AgCl的悬浊液中滴加浓氨水后沉淀溶解,是因为生成了银氨离子而使AgCl的溶解平衡向右移动 |
分析 A.KSP只与温度有关,温度不变,则溶度积不变;
B.氯化银和铬酸银的类型不同,不能直接用溶度积大小判断溶解度大小;
C.Qc与KSP差别越大,越容易生成沉淀;
D.银离子与氨水生成氢氧化二氨合银,银离子浓度减小,则氯化银的溶解平衡向右移动.
解答 解:A.KSP只与温度有关,与溶液中离子浓度无关,则AgCl在饱和NaCl溶液中的KSP与在纯水中的KSP相等,故A错误;
B.氯化银和铬酸银的类型不同,不能由Ksp的大小直接判断溶解能力的大小,故B错误;
C.在AgCl饱和溶液中,Qc(AgCl)=c(Ag+)•c(Cl-)=0.001mol•L-1×0.001mol•L-1=1×10-6mol2•L-2>1.8×10-10mol2•L-2,在Ag2CrO4饱和溶液中,Qc(Ag2CrO4)=c(Ag+)2•c(CrO42-)=0.001mol•L-1×0.001mol•L-1×0.001mol•L-1=1×10-9mol3•L-3>1.9×10-12mol3•L-3,所以均会产生沉淀,但以AgCl沉淀为主,故C错误;
D.AgCl的悬浊液中滴加浓氨水后,银离子与氨水生成氢氧化二氨合银,使平衡向右移动,从而使氯化银溶解,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,注意掌握难溶物的溶解平衡及其沉淀转化的本质,明确同种类型的难溶物,才可以直接用溶度积比较溶解度大小,否则需要通过计算判断.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
 ,写出水分子的电子式
,写出水分子的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氨气和碳酸钠都是电解质 | |
| B. | 常温常压下,22.4L CO2气体的物质的量大于1mol | |
| C. | 2.4克石墨和C60的混合物所含碳原子数约为0.2×6.02×1023 | |
| D. | 氢氧化铁胶体较稳定,是因为该胶体带有正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ和II两途径达到平衡时,体系内各成分的体积分数相同 | |
| B. | 达到平衡时,Ⅰ途径的反应速率v(H2)等于Ⅱ途径的反应速率v(H2) | |
| C. | 达到平衡时,Ⅱ途径体系内混合气体的压强是Ⅰ途径内混合气体压强的2倍 | |
| D. | 达到平衡时,Ⅰ途径体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图装置电解精炼铝 用图装置电解精炼铝 | |
| B. |  用图装置制备Fe(OH)2 用图装置制备Fe(OH)2 | |
| C. | 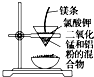 用图装置可制得金属锰 用图装置可制得金属锰 | |
| D. | 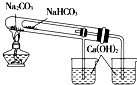 用图装置验证NaHCO3和Na2CO3的热稳定性 用图装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 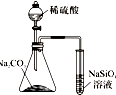 用图实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图实验可用于比较铝、铁的金属性的强弱 | |
| C. | 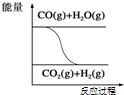 图表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| D. | 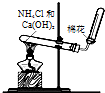 图装置可用于实验室制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com