
分析 (1)BiCl3水解生成BiOCl沉淀和氯化氢;
(2)若把适量固体BiCl3置于浓NaCl溶液或浓盐酸中可得到澄清溶液,说明能抑制其水解;BiOCl中Bi显+3价,O显-2价,Cl显-1价,而次氯酸中Cl显+1价;
(3)其原理是在酸性介质中,Mn2+被氧化成MnO4-,NaBiO3被还原成Bi3+,酸性介质是提供酸性环境,但不能被氧化,不能是强氧化性的酸;
解答 解:(1)BiCl3水解生成BiOCl和HCl,方程式为BiCl3+H2O?BiOCl+2HCl,
故答案为:BiCl3+H2O?BiOCl+2HCl;
(2)配制BiCl3溶液时,应抑制BiCl3的水解,把适量固体BiCl3置于浓NaCl溶液或浓盐酸中加水稀释到所需浓度,把BiOCl称为次氯酸铋是不合理,BiOCl中Bi显+3价,O显-2价,Cl显-1价,而次氯酸中Cl显+1价,所以不能叫次氯酸铋,
故答案为:把适量固体BiCl3置于浓NaCl溶液或浓盐酸中加水稀释到所需浓度;不合理;BiOCl中Bi显+3价,O显-2价,Cl显-1价,而次氯酸中Cl显+1价,所以不能叫次氯酸铋;
(3)NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子,该反应的离子方程式为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O,在调节溶液酸性时不应选用强氧化性酸,不能选用还原性酸,
A.稀硫酸不能被氧化,也不能氧化锰离子,可以提供酸性环境,故A正确;
B.稀盐酸溶液中氯离子易被氧化为氯气,故B错误;
C.稀硝酸具有氧化性,故C错误;
D.高氯酸具有氧化性,故D错误;
故选A,
故答案为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O;A;
点评 本题考查了物质制备方案的设计流程分析判断,离子性质和检验的应用,方程式的书写是难点,主要是题干信息的理解应用,题目难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物 干冰 SO2 | B. | 碱 苛性钠 NaOH | ||
| C. | 盐 钡餐 BaCO3 | D. | 单质 氯水 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂 | B. | 油漆 | C. | 石油 | D. | 煤焦油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中所有原子都在同一平面内 | |
| B. | 能与溴水发生加成反应使其褪色 | |
| C. | 能与浓HNO3在一定条件下发生取代反应 | |
| D. | 能与酸性KMnO4溶液反应使其褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
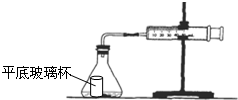 盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:
盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/mL•s-1 | 0.4 | 1.0 | 1.1 | 1.3 | 0.9 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\overline{v}$(O2)=0.01mol/(L•s) | B. | $\overline{v}$(NO)=0.08mol/(L•s) | ||
| C. | $\overline{v}$(H2O)=0.0013mol/(L•s) | D. | $\overline{v}$(NH3)=0.002mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
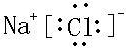 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
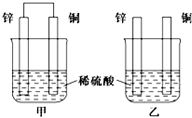 (1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com