
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④ |
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料电池的燃料都在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯、苯乙烯都既使酸性高锰酸钾褪色,也能使溴水褪色 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 肥皂是高级脂肪酸与甘油的酯化产物 | |
| D. | 石蜡是从石油中获取的油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +184.6kJ•mol-1 | B. | -92.3kJ•mol-1 | C. | -69.2kJ•mol-1 | D. | +92.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
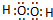 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中有下列平衡Cl2+H2O═HCl+HClO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 氨水中加入NaOH固体有利于氨气的溢出 | |
| D. | pH=1的盐酸加水稀释到原体积的100倍后,PH=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
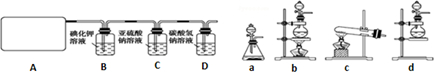
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4+H2S═CuS↓+H2SO4 | |
| B. | 2FeCl3+Cu═2FeCl2+CuCl2 | |
| C. | .Cu2 (OH)2CO3 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | |
| D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SrCO3的溶解度不变,KSP不变 | B. | SrCO3的溶解度不变,KSP增大 | ||
| C. | SrCO3的溶解度增大,KSP不变 | D. | SrCO3的溶解度减小,KSP增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com