
| A. | 将pH=a的醋酸稀释变为pH=a+1,醋酸的浓度则变为原来的$\frac{1}{10}$ | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$变小 | |
| C. | pH=a的醋酸与pH=a+1的醋酸分别中和等物质的量的NaOH溶液,二者所消耗体积比为1:10 | |
| D. | 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
分析 A.醋酸为弱酸,加水稀释促进电离;将pH=a的醋酸稀释变为pH=a+1,体积应小于原来的10倍;
B.将pH=a的醋酸稀释为pH=a+1的过程中,醋酸电离程度增大,结合醋酸、氢离子的物质的量判断;
C.醋酸浓度越大,电离程度越小;
D.pH=a的醋酸与pH=b的NaOH溶液恰好中和,醋酸和氢氧化钠的物质的量相等.
解答 解:A.如醋酸为强酸,则将pH=a的醋酸稀释变为pH=a+1,醋酸的浓度则变为原来的$\frac{1}{10}$,但醋酸为弱酸,加水稀释促进电离,将pH=a的醋酸稀释变为pH=a+1,体积应小于原来的10倍,则醋酸的浓度大于原来的$\frac{1}{10}$,故A错误;
B.将pH=a的醋酸稀释为pH=a+1的过程中,醋酸电离程度增大,n(CH3COOH)减小,n(H+)增大,则$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$减小,故B正确;
C.醋酸浓度越大,电离程度越小,则pH=a的醋酸电子程度较小,pH=a的醋酸与pH=a+1的醋酸分别中和等物质的量的NaOH溶液,二者所消耗体积比大于1:10,故C错误;
D.pH=a的醋酸与pH=b的NaOH溶液恰好中和,醋酸和氢氧化钠的物质的量相等,如醋酸为强酸时存在a+b=14,但醋酸为弱酸,故D错误.
故选B.
点评 本题考查弱电解质的电离,侧重于学生的分析能力的考查,为高考常见题型,注意把握弱电解质的电离特点以及影响因素,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
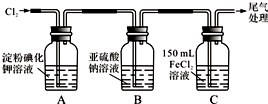
| 实 验 步 骤 | 预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加过量稀盐酸和适量的BaCl2溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在SO42-. |
步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加01mol/L AgNO3溶液,振荡. | 若产生白色沉淀,则B瓶溶液中存在Cl-. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基所含有的电子数是10NA个 | |
| B. | 1mol苯乙烯中含有的碳、碳双键数为4NA个 | |
| C. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
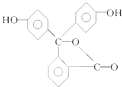
| A. | 酚酞与水可以形成氢键 | |
| B. | 酚酞的分子式为C20H14O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在一定条件下能够发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含共用电子对数目为$\frac{a}{7+1}$NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$ L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温材料的元素 | |
| C. | 在金属元素区域中可以寻找制备新型农药材料的元素 | |
| D. | 23592U可用作核反应堆的燃料,21H与31H可用作制造氢弹的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 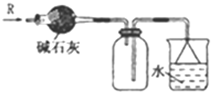 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 | |
| B. | 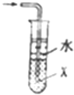 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| C. |  进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 | |
| D. | 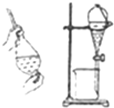 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com