
【题目】下列叙述正确的是( )
A. 汽油、柴油和植物油都是碳氢化合物
B. 乙醇可以被氧化为乙酸,二者均能发生取代、氧化反应
C. 甲烷、乙烯和苯在工业上都可通过石油分馏或裂化得到
D. 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
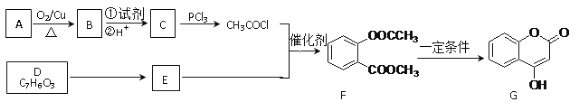
已知:RCOOH![]() RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
请回答下列问题:
⑴B→C的转化所加的试剂可能是__________,C+E→F的反应类型是_______。
⑵有关G的下列说法正确的是_________。
A.属于芳香烃 B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应 D.1mol G最多可以跟4mol H2反应
⑶E的结构简式为_________。
⑷F与足量NaOH溶液充分反应的化学方程式为__________________________________。
⑸写出同时满足下列条件的E的同分异构体的结构简式_______________。
①发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
⑹已知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。

(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将H2和I2(g)各0.16mol充入10L恒容密闭容器中,发生反应H2(g)+I2(g)![]() 2HI(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下:
2HI(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下:
t/min | 2 | 4 | 7 | 9 |
N(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A. 反应前4min的平均速率v(HI)=2.5×10-3mol/(Lmin)
B. 当体系压强不再改变时可以判断反应达到平衡状态
C. 该温度下此反应的书衡常数K=1.44
D. 再充入0.05molH2、0 .05molI2(g)和0.06molHI,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 硫粉在过量的纯氧中燃烧可以生成SO3
B. 可以用澄清石灰水鉴别SO2和CO2
C. SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性
D. SO2通入到紫色石蕊试液中,溶液只变红不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B(g)![]() 2C(g),反应过程中混合物中C的百分含量与温度关系如下图所示下列说法正确的是
2C(g),反应过程中混合物中C的百分含量与温度关系如下图所示下列说法正确的是

A. 正反应速率:v(T3)>v(T4)>v(T2) B. 化学平衡常数:K(T4)>K(T3)
C. 由T1向T2变化时,V正>v逆 D. 该可逆反应的正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还含有少量Fe2O3、SiO2等杂质)提取氧化铝

操作过程如下:
(1)沉淀A中主要含有 (填化学式),沉淀B中含有 (填化学式);
(2)(Ⅰ)(Ⅱ)步骤中分离溶液和沉淀的操作名称是 ;
(3)滤液X中,除了H+、Fe3+外,还含有大量的阳离子是 ;
(4)写出(Ⅳ)步骤中氢氧化铝加热分解的化学方程式: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com