
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
A.c1:c2=3:1
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等
D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论不正确的是( )
A.由C(s,石墨)═C(s,金钢石) △H>0可知,金刚石比石墨稳定
B.CO(g)燃烧热是283.0kJ•mol﹣1,则2CO2(g)═2CO(g)+O2(g)△H=+566.0kJ•mol﹣1
C.CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,该反应的化学能可以转化为电能
D.已知C(s)+O2(g)═CO2(g)△H1,C(s)+ O2(g)═CO(g)△H2,则△H1<△H2
O2(g)═CO(g)△H2,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:填空题
在一定温度下,向一个容积不变的容器中,通入2mol SO2和2mol O2及固体催化剂,使之反应。2SO2(g)+O2(g) 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入2mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 ;
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol  SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
①达到平衡时,⑴与⑵放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者
②a、b、c必须满足的关系是 、 (一个用a、c表示,另一个用 b、c表示),
b、c表示),
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
把4 mol A气体和4 mol B气体混合放入2 L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g)  C(g)+2D(g);经5min达到平衡, 测得压强减小了10%,下列说法中正确的是
C(g)+2D(g);经5min达到平衡, 测得压强减小了10%,下列说法中正确的是
A.平衡体系中C的体积分数为1/9
B.平衡时A的浓度为2.4mol/L
C.D的平均速率为0.32mol/(L·min)
D.B的转化率为20%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.HI(g)  1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
B.在稀溶液中,H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.由C(石墨)==C(金刚石) ΔH=1.90 kJ·mol-1可知,金刚石比石墨稳定
D.在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2 燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1
燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
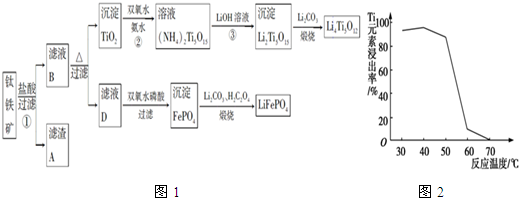
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
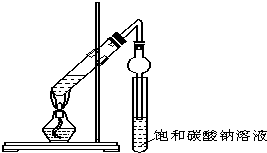 某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com