
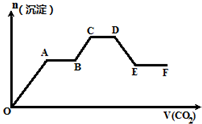
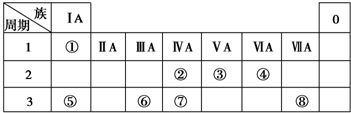
 将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )| A. | O~A段反应的离子方程式是Ba2++CO32-═BaCO3↓ | |
| B. | A~B段反应的离子方程式是2OH-+CO2═CO${\;}_{3}^{2-}$+H2O | |
| C. | A~B段与C~D段所发生的反应相同 | |
| D. | D~E段沉淀的减少是由于碳酸钡固体与CO2的水溶液反应所致 |
分析 只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=Ba CO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生CO32-+CO2+H2O=2HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,以此解答该题.
解答 解:只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=Ba CO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生CO32-+CO2+H2O=2HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,
A.由上述分析可知,O~A段发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,故A正确;
B.由上述分析可知,A~B段发生2KOH+CO2=K2CO3+H2O,离子方程式2OH-+CO2═CO32-+H2O,故B正确;
C.由上述分析可知,C~D段发生CO32-+CO2+H2O=HCO3-,由B可知两阶段反应不相同,故C错误;
D.D~E段发生反应BaCO3+CO2+H2O=Ba(HCO3)2,导致沉淀的减少,故D正确;
故选C.
点评 本题以图象题形式考查反应先后顺序问题,为高频考点,侧重对基础知识的综合考查,把握元素化合物性质及发生的反应、图象与反应的对应关系是关键的关键,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 (1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
(1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
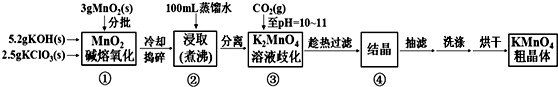
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:3 | C. | 1:4:1 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
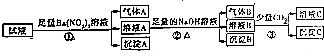
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→
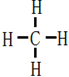 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com