
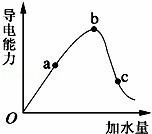
如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.
(1)“O”点为什么不导电 .
(2)a、b、c三点的氢离子浓度由小到大的顺序为 .
(3)a、b、c三点中,醋酸的电离程度最大的一点是 .
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
(1)溶液是通过离子的定向移动形成电流的;
(2)溶液的导电能力与离子浓度成正比;
(3)溶液越稀,醋酸的电离程度越大.
解答:
解:(1)溶液是通过离子的定向移动形成电流的,冰醋酸中醋酸以分子存在,不存在离子,所以冰醋酸不导电,故答案为:冰醋酸中不存在离子;
(2)溶液的导电能力与离子浓度成正比,根据图象知,溶液导电能力大小顺序是b>a>c,则氢离子浓度由小到大顺序是c<a<b,故答案为:c<a<b;
(3)溶液越稀,醋酸的电离程度越大,根据图象知,溶液体积大小顺序是c>b>a,所以醋酸电离程度最大的是c,故答案为:c.
点评:
本题考查了弱电解质的电离,明确溶液导电能力的影响因素、弱电解质电离程度与溶液浓度的关系是解本题关键,正确分析图象即可,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 葡萄糖和蛋白质都可以发生水解 |
|
| B. | 油脂和聚乙烯都是高分子化合物 |
|
| C. | 煤和石油都属于不可再生能源 |
|
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为: .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是 .
(4)根据VSEPR模型,H3O+的分子立体结构为: ,SO2的立体结构为: .
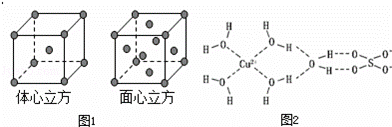
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图1所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 .
(6)胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图2,其中配位键和氢键均采用虚线表示.
①写出基态Cu原子的核外电子排布式: 1s22s22p63s23p63d104s1或[Ar]3d104s1 ②写出胆矾晶体中水合铜离子的结构简式(用配位键表示): .
(7)决定离子空间结构的因素有 、 和离子键的纯粹程度.
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离过程为H2O⇌H++OH﹣,在25℃时,水的离子积:KW=1×10﹣14,在35℃时,水的离子积:KW(35℃)=2.1×10﹣14,则下列叙述正确的是( )
|
| A. | c(H+)随着温度的升高而降低 |
|
| B. | 35℃时,c(H+)<c(OH﹣) |
|
| C. | 35℃时的水比25℃时的水电离程度小 |
|
| D. | 水的电离是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为 ;
(2)反应是 反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(CH2)=c(CO)•c(H2O),试判断此时的温度为 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
| T | ||
| X | Y | Z |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是( )
A.X位于元素周期表中第三周期第VIA族
B.Z元素的气态氢化物为极性分子
C.Y元素最高价氧化物对应水化物为强酸
D.五种元素中原子半径最大的是R
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钡的活动性处于钾和钠之间,则下述说法中可能实现的是( )
A.钡可从氯化钾溶液中置换出钾
B.在溶液中钡离子可氧化金属锌,使之成为锌离子
C.钡可从氯化钠溶液中置换出钠
D.钡可从冷水中置换出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO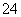
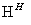 Cr2O
Cr2O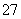
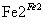 Cr3+
Cr3+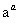 Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO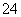 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O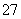 (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O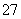 )=v(CrO
)=v(CrO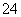 )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO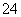 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O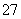 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com