
| A. | S→SO3可以一步实验 | |
| B. | S是淡黄色固体,易溶于水 | |
| C. | Fe+S→FeS,Fe+Cl2→FeCl3,说明氧化性:Cl2>S | |
| D. | 试管壁上残留的S可以用酒精清洗 |
分析 A.硫单质不能一步反应生成三氧化硫;
B.硫单质难溶于水;
C.氯气氧化性强氧化铁为高价化合物,硫单质氧化性弱氧化铁为硫化亚铁;
D.硫单质微溶于酒精.
解答 解:A.S+O2=SO2,不能直接生成三氧化硫,故A错误;
B.S是淡黄色固体,难溶于水,微溶于酒精,易溶于二硫化碳,故B错误;
C.Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,说明氧化性:Cl2>S,故C正确;
D.硫单质微溶于酒精易溶于二硫化碳,试管壁上残留的S不可以用酒精清洗,用二硫化碳洗涤,故D错误;
故选C.
点评 本题考查了硫的性质分析、反应条件和产物的判断、注意氧化性强弱比较的方法和溶解性大小的应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol•L-1 | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol•L-1 | D. | 溶液中c(Ag+)≈3.2×10-8mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
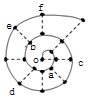 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
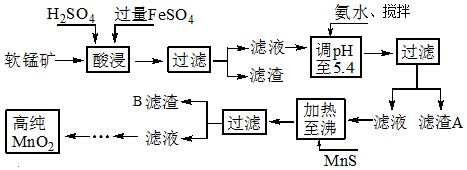
| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
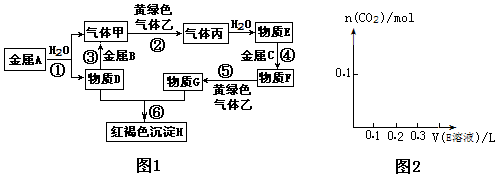
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: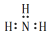 | B. | Mg2+结构示意图: | ||
| C. | 乙酸的结构简式:CH3COOH | D. | 乙醇的分子式C2H5OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com