
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液的pH与NaOH客液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:________。
②b点时溶液中c(H2N2O2)________c(N2O22-)。(填“>”“<”或“=”下同)
③a点时溶液中c(Na+)________c(HN2O2-)+c(N2O22-)。
【答案】 +1 H2N2O2![]() H++HN2O2-, HN2O2-
H++HN2O2-, HN2O2-![]() H++N2O22- > >
H++N2O22- > >
【解析】(1)H2N2O2分子中H的化合价为+1,O元素的化合价为-2,设N元素的化合价为x,根据总化合价之和为0可知:2x+(+1)×2+(-2)×2=0,解得:x=1,即N元素的化合价为+1,故答案为:+1;
(2)①根据图像可知,氢氧化钠溶液体积为0时,0.01mol/L的H2N2O2溶液的pH=4.3,说明H2N2O2为二元弱酸,二元弱酸以第一步电离为主,则其电离方程式为:H2N2O2![]() HN2O2-+H+,HN2O2-
HN2O2-+H+,HN2O2- ![]() H++N2O22-,故答案为:H2N2O2
H++N2O22-,故答案为:H2N2O2![]() HN2O2-+H+,HN2O2-
HN2O2-+H+,HN2O2- ![]() H++N2O22-;
H++N2O22-;
②b点溶质为NaHN2O2,溶液的pH>7,说明溶液显示碱性,则HN2O2-的水解程度大于其电离程度,所以c(H2N2O2)>c(N2O22-),故答案为:>;
③根据图像可知,a点时溶液的pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(HN2O2-)+2c(N2O22-),所以c(Na+)>c(HN2O2-)+c(N2O22-),故答案为:>。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】某科技小组利用NaClO, NaClO2复合吸收剂研究烟气脱硫脱硝技术.
(1)随着pH值的增大,烟气脱硫和脱硝效率均呈下降趋势,可能的原因是_________。
(2)若其他条件不变,改变脱硫脱硝温度对脱除效率的影响如下图所示:
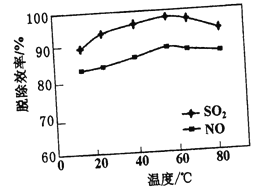
随着温度的升高,脱硫和脱硝的效率先缓慢增加,后逐渐下降,分析可能原因有____、_____。
(3)在脱硫脱硝过程中存在ClO2、ClO2-和ClO3-,它们的含量可采用连续碘量滴定法测定。已知:碘量法的瘾定反应为I2+2S2O32-=2I-+S4O62-。
实验方法:取VmL试样,控制溶液pH,加入20%的碘化钾溶液4mL,暗处放置5分钟后,用0.01mol/LNa2S2O3溶液滴定,淀粉作指示剂,记录消耗Na2S2O3溶液体积。三次实验的溶液pH、反应及消耗Na2S2O3溶液的体积见下表:
实验 | pH | 反应 | Na2S2O3溶液体积/mL |
① | pH=7.0 | 2C1O2+2I-=I2+2ClO2- | V1 |
② | pH=4.0 | ClO2-+4I-+4H+=2I2+Cl-+2H2O | V2 |
③ | pH<0.1 | ClO3-+6I-+6H+=3I2+Cl-+3H2O 2ClO2+10I-+8H+=5I2+2Cl-+4H2O ClO2-+4I-+4H+=2I2+Cl-+2H2O | V3 |
注:实验②控制pH前先鼓入氮气以除去ClO2。
计算试样中ClO3-的浓度为多少mg/L(写出计算过程,用含V1、V2、V3、V的代数式表示)_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能够鉴定卤代烃中卤元素存在的操作是 ( )
A. 在卤代烃中直接加入AgNO3溶液
B. 加蒸馏水,充分搅拌后,加入AgNO3溶液
C. 加入NaOH溶液加热后,再加入AgNO3溶液
D. 加入NaOH溶液加热后加入稀硝酸酸化,再加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。图中E为量气装置。

本实验可供选用的药品还有:稀硫酸、稀盐酸、过氧化钠、大理石、水。
试回答:
(1)图中装置的连接顺序是(填装置的字母编号),其中连接胶管及支持装置省略:_________。
(2)装置C中放入的反应物是________和_________________。(写化学式)
(3)装置A的作用是__________________;装置B的作用是_______________。
(4)装置D中发生的化学反应方程式为__________________________。
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意_____________。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 在滴加石蕊试液后呈红色的溶液中:Na+、K+、Al3+、CO32-
C. ![]() 的溶液中:NH4+、SO42-、NO3-、CO32-
的溶液中:NH4+、SO42-、NO3-、CO32-
D. 由水电离出的c(H+)=1×10-13mol/L的溶液:Al3+、NH4+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质灼烧时,焰色反应为黄色,下列判断正确的是( )
A.该物质一定含钠元素,不能确定是否含有K元素
B.该物质一定是金属钠
C.该物质一定只含钠元素
D.该物质一定是钠的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g) △H<0,下列判断其中不正确的是
cC(g)+dD(g) △H<0,下列判断其中不正确的是
A. 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b<c+d
B. 若从正反应开始,平衡时,A、B的转化率相等,则投入A、B的物质的量之比为a:b
C. 若平衡体系中共有气体Mmol,再向其中充入bmolB,达到平衡时气体总物质的量为( M+b)mol,则a+b=c+d
D. 若a+b=c+d,对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
A. 达平衡时间甲比乙短
B. 乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小
C. 达平衡时,甲中SO2的浓度比乙中SO2的浓度大
D. 达平衡时,甲的转化率比乙低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com