
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是

A.Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol·L-1
C.该温度下醋酸的电离平衡常数为10—4.75 mol·L-1
D.向X点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液 :c(H+)=c(CH3COOH)+c(OH-)
AC
【解析】
试题分析:混合溶液中醋酸含量多酸性强,醋酸钠含量多碱性强,故图像中实线为CH3COO-,虚线为CH3COOH。 A、由图得出Y点所表示的溶液中CH3COO-含量高,溶液为酸性,正确;B、溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,故有c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1,错误;C、在X点,c(CH3COOH)=c(CH3COO-),电离平衡常数为k= c(CH3COO-)×c(H+)/ c(CH3COOH)= c(H+)= 10—4.75 mol·L-1,正确;D、此时溶液为醋酸钠溶液,质子守恒式为c(OH-)=c(CH3COOH)+c(H+),错误。
考点:考查溶液中微粒浓度关系有关问题。


科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:填空题
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序 。
(2)下列说法错误的是 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物 (高或低),原因是 。
(4)B单质的一种同素异形体的晶胞如图甲所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为 cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
① F原子的外围电子排布式为________。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为 。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图乙所示的离子:该离子中碳原子的杂化方式有 。


图甲 图乙
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:填空题
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO (g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0
0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)= 2C(s)+O2(g)
已知该反应的△H 0,判断该设想能否实现并简述其依据: 。
0,判断该设想能否实现并简述其依据: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省南昌市高三3月第一次模拟考试理综化学试卷(解析版) 题型:选择题
我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是
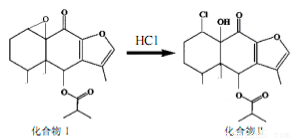
A.化合物I分子式为C19H24O5
B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。



(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体
C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
下列有关化学用语或名称表达正确的是
A.亚硫酸的电离方程式:H2SO3 2H++SO32-
2H++SO32-
B.乙炔的分子结构模型示意图:
C.H2O2的电子式:
D. 的名称3-甲基-1-丁醇
的名称3-甲基-1-丁醇
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
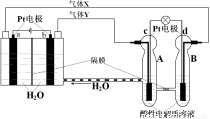
A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:填空题
甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l) ΔH2
CH3OH(g) + H2O(l) ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g) ΔH3=-41.1 KJ/mol ③
H2O (l) =H2O (g) ΔH4=+44.0KJ/mol ④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol?L-1)变化如下表所示:(前6min没有改变条件)
| 2min | 4min | 6min | 8min | … |
CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
H2 | x | 0.12 | 0.12 | 0.2 | … |
CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
①x= 。
②250℃时该反应的平衡常数K值为: (不必化简)。
③若6min~8min只改变了某一条件,所改变的条件是 。
④第8min时,该反应是不是达到平衡状态 。(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ. 。
(3)电解甲醇水溶液制氢的优点是需要的电压低,而且制得的氢气比电解相同物质的量的水多。写出电解甲醇水溶液的反应式为:阳极: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com