
| A. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| B. | 烷烃中含饱和键、烯烃、炔烃中含不饱和键 | |
| C. | 能发生加成反应的一定是烯烃 | |
| D. | 符合通式CnH2n+2的一定是烷烃,符合通式CnH2n的一定是烯烃. |
分析 A.烯烃中α-H原子活泼,可以发生取代反应;
B.烷烃只含有C-C单键与C-H单键,烯烃中含有C═C双键,炔烃中含有碳碳三键;
C.烯烃、炔烃、芳香烃都能够发生加成反应;
D.CnH2n+2为烷烃的通式,CnH2n可能为烯烃或环烷烃.
解答 解:A.烯烃中α-H原子较活泼,则烯烃能发生取代反应,故A错误;
B.烷烃中只含有单键,不存在不饱和键,而烯烃和炔烃中分别含有碳碳双键、碳碳三键,故B正确;
C.含有不饱和键的化合物都能够发生加成反应,如烯烃、炔烃等,所以能发生加成反应的不一定是烯烃,故C错误;
D.通式CnH2n+2是饱和烃烷烃,而通式CnH2n可能是环烷烃,不一定为烯烃,故D错误;
故选B.
点评 本题考查了饱和烃、不饱和烃的性质及判断,题目难度不大,明确常见烃的组成、结构及性质为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
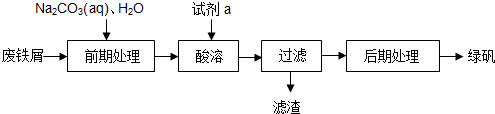
 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中的离子反应方程式是:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ | |
| B. | ②中的离子反应方程式是:2Na++CO32-+H2O+CO2=2NaHCO3↓ | |
| C. | 上述变化说明相同温度下溶解度Na2CO3>NaHCO3>NaCl | |
| D. | 向饱和CaCl2溶液中加入浓Ba(OH)2溶液,也会析出晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1•s-1 | B. | 0.4 mol•L-1•s-1 | C. | 0.6 mol•L-1•s-1 | D. | 0.8 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体.而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊.D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体.请回答下列问题:
(1)A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体.而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊.D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com