
| A. | 电子数总为10NA的NH4+中含有质子的物质的量为10mol | |
| B. | 在标准状况下,所含氯原子数为3NA的CHCL3体积约为22.4L | |
| C. | 足量氢氧化钠溶液中通入lmolCL2,反应中转移的电子数NA | |
| D. | 在标准状况下,气体体积约为22.4L的O2和O3组成的混合气原子总数为1.5NA |
分析 A、铵根离子中含10个电子和11个质子;
B、标况下三氯甲烷为液态;
C、氯气和氢氧化钠的反应为歧化反应;
D、求出混合气体的物质的量,然后根据氧气为双原子分子、臭氧为三原子分析.
解答 解:A、铵根离子中含10个电子和11个质子,故电子数总为10NA的NH4+的物质的量为1mol,含11NA个质子,故A错误;
B、标况下三氯甲烷为液态,故当含氯原子为3NA的三氯甲烷为1mol,但体积小于22.4L,故B错误;
C、氯气和氢氧化钠的反应为歧化反应,故1mol氯气转移NA个电子,故C正确;
D、标况下为22.4L混合气体的物质的量为1mol,而氧气为双原子分子、臭氧为三原子,故1mol混合气体中含有的氧原子介于2NA到3NA之间,但不一定为1.5NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 稳定性:HCl>H2S>PH3 | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 还原性:F->CI->Br - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2ˉ | B. | Al3+ | C. | Al(OH)3 | D. | Al3+和Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | X | Y | Z | W | M | Q |
| 原子半径/nm | 0.037 | 0.074 | 0.099 | 0.186 | 0.102 | 0.143 |
| 主要化合价 | +1 | -2 | -1、+7 | +1 | -2、+6 | +3 |
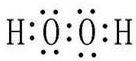 .
.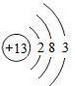 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应时,增加水的量 | |
| B. | 锌与稀硫酸反应时,加入少量CuSO4固体 | |
| C. | 用18mol/L的硫酸溶液代替2m0l/L硫酸溶.液常温下与铝反应 | |
| D. | 锌与稀硫酸反应时,加入少量醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图示实验室化学试剂浓硫酸标签上的部分内容.现需要490ml1.0moL•L-1H2SO4溶液.用该浓硫酸和蒸馏水配制,可供选用的仪器有:
如图示实验室化学试剂浓硫酸标签上的部分内容.现需要490ml1.0moL•L-1H2SO4溶液.用该浓硫酸和蒸馏水配制,可供选用的仪器有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性重铬酸钾溶液检验酒驾,是因为乙醇被还原 | |
| B. | 酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 | |
| C. | 石油中含有C5~C11的烷烃,可以通过分馏得到汽油 | |
| D. | 煤中含有苯和甲苯,可以用先干馏,后蒸馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能发生皂化反应 | B. | 都可以在稀硫酸中水解生成酸和醇 | ||
| C. | 都具有酯基 | D. | 油脂可用于生产肥皂和油漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应速率为1.2 mol/(L•s) | |
| B. | 用物质B表示的反应速率为0.6 mol/(L•s) | |
| C. | 2 s时物质A的浓度为2.8mol/L | |
| D. | 2 s时物质B的浓度为0.6 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com