
ij�о���ѧϰС��Ϊ�ϳ�1-�������������ϵ�֪һ���ϳ�·�ߣ�
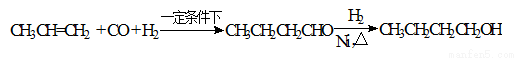
CO���Ʊ�ԭ ����HCOOH
����HCOOH CO��+H2O������Ƴ�ԭ�������Ʊ�װ�ã�����ͼ��
CO��+H2O������Ƴ�ԭ�������Ʊ�װ�ã�����ͼ��

����д���пհף�
��1��ʵ��������п����ϡ���ᡢϡ���ᡢŨ���ᡢ2-����������ѡ����ʵ��Լ��Ʊ���������ϩ��д���Ʊ���ϩ�Ļ�ѧ����ʽ�� ��
��2����������װ���Ʊ����﴿����CO��װ����a�������� ��װ����b�������� ��c��ʢװ���Լ��� ��
��3���Ʊ�ϩʱ������������SO2��CO2��ˮ��������С���������Լ��������������壬�������ͨ���Լ���˳���� ������ţ��Լ����ظ�ʹ�ã�
�ٱ���Na2SO3��Һ
������KMnO4��Һ
��ʯ��ˮ
����ˮCuSO4
��Ʒ����Һ
��4������ȩ��������õ�����������ȩ��1-������Ʒ��Ϊ����1-��������С���������֪��
��R��CHO+NaHSO3(����) RCH(OH)SO3Na����
RCH(OH)SO3Na����
�ڷе㣺����34�棬1-����118�棬����Ƴ������ᴿ·�ߣ�

�Լ�1Ϊ ������2Ϊ ������3Ϊ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶����¿��Ļ�ѧ���������棩 ���ͣ�ѡ����
��25��ʱ����0.1 mol��L��1��HA��Һ��0.1 mol��L��1��NaOH��Һ�������Ϻ�û����ҺpH��8������������ʾ�ĸû����Һ���й�����Ũ�ȹ�ϵ�У��������
A��c(HA)��c(A��)��c(Na��)��0.1 mol��L��1
B��c(Na��)��c(A��)��c(OH��)��c(H��)
C��c(Na��)��c(A��)��c(OH��)��c(H��)
D��c(OH��)��c(H��)��c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ɹŸ߶����¿�����ѧ���������棩 ���ͣ�ѡ����
ç��������ںϳ�ҩ���ƣ���ṹ��ʽ��ͼ�����й���ç�����˵����ȷ���� �� ��

A������ʽΪC7H6O5
B�������к������ֹ�����
C��1mol���л�������4molNaOH��Ӧ
D���ɷ����ӳɺ�ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ12���¿���ѧ���������棩 ���ͣ�ѡ����
����������ȷ����
A�����³�ѹ�£�1.5 mol O2�����ԼΪ33.6 L
B��NaOH��Ħ��������40 g
C��100 mLˮ���ܽ���5.85 g NaCl������Һ��NaCl�����ʵ���Ũ��Ϊ1 mol��L-1
D��ͬ��ͬѹ�£���ͬ������κ����������ķ�����һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ12���¿���ѧ���������棩 ���ͣ�ѡ����
�̷������������谷���ṹ��ͼ�����������������彡�������й��������谷��˵��������ǣ�ͼ�е�˫��Ϊ���õ��Ӷԣ�
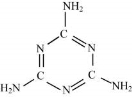
A����� B������
C�������� D������ʽΪC3H6N6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶�12���¿���ѧ���������棩 ���ͣ�ѡ����
����˵����ȷ����
A����֪��
����Լ������Ӧ �Ħ�HΪ��384 kJ/mol
�Ħ�HΪ��384 kJ/mol
B������ı�ȼ����Ϊ��5518 kJ/mol��������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
C8H18(g)+12.5O2(g)=== 8CO2(g)+9H2O(g)����H=��5518 kJ/mol
C��2CO(g)+O2(g)===2CO2(g) ����H=��566 kJ/mol

��ͼ�ɱ�ʾ�÷�Ӧ�����������Ĺ�ϵ
D ��S(s)+O2(g)===SO2(g)����H1
��S(s)+O2(g)===SO2(g)����H1
S(g)+O2(g)===SO2( g)����H 2 ��H1����H2
g)����H 2 ��H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶�12���¿���ѧ���������棩 ���ͣ�ѡ����
ͨ�����·�Ӧ���ɻ�ȡH2�������й�˵����ȷ����
��̫������ֽ�ˮ���⣺2H2O(l)=2H2��g����O2��g����H1=571.6kJ��mol�C1
�ڽ�̿��ˮ��Ӧ���⣺C��s����H2O(g)=CO��g����H2��g����H2=131.3kJ��mol�C1
�ۼ�����ˮ��Ӧ���⣺CH4��g����H2O(g)=CO��g����3H2��g����H3=206.1kJ��mol�C1
A����Ӧ���е���ת��Ϊ��ѧ��
B����Ӧ��Ϊ���ȷ�Ӧ
C����Ӧ��ʹ�ô�������H3��С
D����ӦCH4��g��=C��s��+2H2��g���Ħ�H=74.8kJ��mol�C1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��������֥һ�и�һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У����ڷǵ���ʵ���( )
A��SO2 B������ C��̼�� D��NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��һ�����л�ѧ���������棩 ���ͣ������
��1��д�����з�Ӧ�����ӷ�Ӧ����ʽ
����С�մ�Ƭ����θ���������ӷ���ʽΪ______________________
���������ͬʱ����θ����ʱ��÷���θ��ƽ{��Ҫ�ɷ���Al��OH��3}����Ӧ�����ӷ���ʽΪ__________________________
������������Һ�еμӹ�������������_________________________
��2�� д�������������ӷ�Ӧ�Ļ�ѧ����ʽ
��Ca2++CO32-=CaCO3��________________________
�� Cu2++Fe=Cu+Fe2+______________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com