
| 对二甲苯 | 邻二甲苯 | 间二甲苯 | 苯 | |
| 沸点/℃ | 138 | 144 | 139 | 80 |
| 熔点/℃ | 13 | 25 | 47 | 6 |
| A. | 该反应属于取代反应 | |
| B. | 用蒸馏的方法可将苯从反应所得产物中首先分离出来 | |
| C. | 甲苯的沸点高于144℃ | |
| D. | 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来 |
分析 甲苯发生取代反应生成二甲苯,由表中数据可知苯与二甲苯的沸点相差较大,可用蒸馏的方法分离,而对二甲苯熔点较低,可结晶分离,以此解答该题.
解答 解:A.甲苯变成二甲苯是苯环上的氢原子被甲基取代所得,属于取代反应,故A正确;
B.苯的沸点与二甲苯的沸点相差较大,可以用蒸馏的方法分离,故B正确;
C.甲苯的相对分子质量比二甲苯小,故沸点比二甲苯低,故C错误;
D.因为对二甲苯的沸点较高,将温度冷却至-25℃~13℃,对二甲苯形成固体,从而将对二甲苯分离出来,故D正确;
故选C.
点评 本题考查较为综合,涉及到物质的分离和提纯、有机物的反应类型、沸点高低比较,为高频考点,题目侧重考查学生根据表格的数据分析解决问题的能力,难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,钠长期暴露在空气中生成白色的氧化钠固体 | |
| B. | 铁能与氯气发生反应,故不能用铁制容器贮存氯气 | |
| C. | 铜能与氯化铁溶液发生置换反应,该反应可以用于印刷电路板的制作 | |
| D. | 燃着的镁条伸入盛满氮气的集气瓶中能继续燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
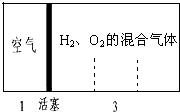 如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
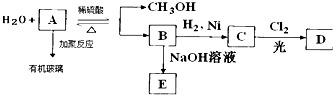
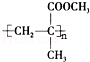 .
. CH3OH+CH2=C(CH3)COOH.
CH3OH+CH2=C(CH3)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
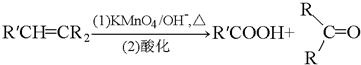
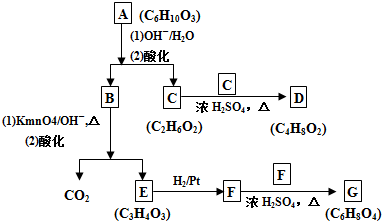
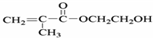 C:CH2OHCH2OH
C:CH2OHCH2OH E:
E: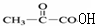
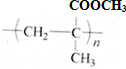 .
.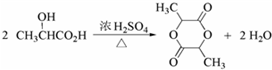 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com