
| A. | 钠的熔、沸点低 | |
| B. | 钠的颜色是银白色的 | |
| C. | 钠与空气中氧气反应,条件不同产物不同 | |
| D. | 因为反应要加热,所以该反应是吸热反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
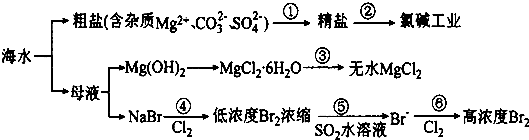
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br一需消耗2.24LCl2 | |
| D. | 在过程③中将MgCl2.6H2O灼烧即可制得无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | c(HCO${\;}_{3}^{-}$)>c(ClO-)>c(OH-) | |
| C. | c(HClO)+c(ClO-)=c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(ClO-)+c(OH-)+c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 工业上利用油脂生产肥皂、用淀粉酿酒、用纤维素生产酒精 | |
| C. | 酸性高锰酸钾紫色溶液中加入植物油充分振荡后,溶液颜色不会因反应褪去 | |
| D. | 蛋白质和油脂在发生腐败变质时,均会产生含NH3的刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2SO4、NaCl | B. | NaCl、Na2SO4、NaOH | ||
| C. | NaOH、NaCl、Na2SO4 | D. | Na2SO4、NaOH、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
| 物质的量分数 | 0.25 | 0.25 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com