
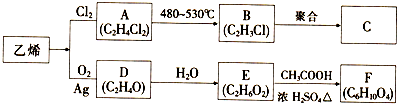
 .
. .
. .
. .
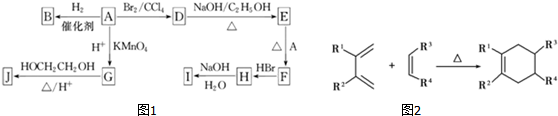
. 分析 根据A中碳氢含量知A是烃,A中碳原子个数=$\frac{82×87.80%}{12}$=6,氢原子个数=$\frac{82×12.20%}{1}$,所以A的分子式为C6H10,A能和氢气发生加成反应生成B,说明A中含有碳碳双键,B的一氯代物仅有一种,说明环烷烃B没有支链,所以A的结构简式为 ,B的结构简式为:
,B的结构简式为: ;A和溴发生加成反应生成D,所以D的结构简式为:
;A和溴发生加成反应生成D,所以D的结构简式为: ,D和氢氧化钠的醇溶液发生消去反应生成E,E能和A发生反应生成F,结合题给信息知,E的结构简式为:
,D和氢氧化钠的醇溶液发生消去反应生成E,E能和A发生反应生成F,结合题给信息知,E的结构简式为: ,F的结构简式为:
,F的结构简式为: ,F和HBr发生加成反应生成H,则H的结构简式为:
,F和HBr发生加成反应生成H,则H的结构简式为: ,H和氢氧化钠的水溶液发生取代反应生成I,I的结构简式为:
,H和氢氧化钠的水溶液发生取代反应生成I,I的结构简式为: ,A被酸性高锰酸钾氧化生成G,碳碳双键能被酸性高锰酸钾氧化生成羧酸,G的分子式为C6H10O4,0.146gG的物质的量=$\frac{0.146g}{146g/mol}$,20mL0.100mol/L NaOH的物质的量=0.100mol/L×0.02L=0.002mol,所以G中含有两个羧基,其结构简式为:HOOC(CH2)4COOH,G和乙二醇反应生成J,J是一种高分子化合物,所以J的结构简式为:
,A被酸性高锰酸钾氧化生成G,碳碳双键能被酸性高锰酸钾氧化生成羧酸,G的分子式为C6H10O4,0.146gG的物质的量=$\frac{0.146g}{146g/mol}$,20mL0.100mol/L NaOH的物质的量=0.100mol/L×0.02L=0.002mol,所以G中含有两个羧基,其结构简式为:HOOC(CH2)4COOH,G和乙二醇反应生成J,J是一种高分子化合物,所以J的结构简式为: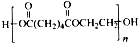 .
.
解答 解:根据A中碳氢含量知A是烃,A中碳原子个数=$\frac{82×87.80%}{12}$=6,氢原子个数=$\frac{82×12.20%}{1}$,所以A的分子式为C6H10,A能和氢气发生加成反应生成B,说明A中含有碳碳双键,B的一氯代物仅有一种,说明环烷烃B没有支链,所以A的结构简式为 ,B的结构简式为:
,B的结构简式为: ;A和溴发生加成反应生成D,所以D的结构简式为:
;A和溴发生加成反应生成D,所以D的结构简式为: ,D和氢氧化钠的醇溶液发生消去反应生成E,E能和A发生反应生成F,结合题给信息知,E的结构简式为:
,D和氢氧化钠的醇溶液发生消去反应生成E,E能和A发生反应生成F,结合题给信息知,E的结构简式为: ,F的结构简式为:
,F的结构简式为: ,F和HBr发生加成反应生成H,则H的结构简式为:
,F和HBr发生加成反应生成H,则H的结构简式为: ,H和氢氧化钠的水溶液发生取代反应生成I,I的结构简式为:
,H和氢氧化钠的水溶液发生取代反应生成I,I的结构简式为: ,A被酸性高锰酸钾氧化生成G,碳碳双键能被酸性高锰酸钾氧化生成羧酸,G的分子式为C6H10O4,0.146gG的物质的量=$\frac{0.146g}{146g/mol}$,20mL0.100mol/L NaOH的物质的量=0.100mol/L×0.02L=0.002mol,所以G中含有两个羧基,其结构简式为:HOOC(CH2)4COOH,G和乙二醇反应生成J,J是一种高分子化合物,所以J的结构简式为:
,A被酸性高锰酸钾氧化生成G,碳碳双键能被酸性高锰酸钾氧化生成羧酸,G的分子式为C6H10O4,0.146gG的物质的量=$\frac{0.146g}{146g/mol}$,20mL0.100mol/L NaOH的物质的量=0.100mol/L×0.02L=0.002mol,所以G中含有两个羧基,其结构简式为:HOOC(CH2)4COOH,G和乙二醇反应生成J,J是一种高分子化合物,所以J的结构简式为: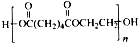 .
.
(1)通过以上分析知,B的结构简式为: ,故答案为:
,故答案为: ;
;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,说明含有碳碳双键,分子中所有的碳原子共平面,则M中的碳碳双键位于中间,相当于乙烯中的氢原子被甲基取代,所以则M的结构简式为 ,故答案为:
,故答案为: ;
;
(3)A和溴发生加成反应生成D,故答案为:加成反应;
(4)G和乙二醇反应生成J,J是一种高分子化合物,则该反应是缩聚反应,反应方程式为: ,
,
故答案为: ;
;
(5)E和A发生加聚反应生成F,该反应方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断和合成,关键是确定B的分子结构,结合反应信息与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生自学能力与迁移运用能力,难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 方法或现象 | 结论 |
| A | 检查该装置气密性: | 将注射器针管向右拉动一段距离后松手,能够恢复原位 | 气密性良好 |
| B | 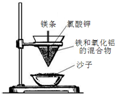 | 点燃镁条后,火花四射,在蒸发皿中产生红热的金属 | 铝热反应: 2Fe+Al2O3$\frac{\underline{\;高温\;}}{\;}$2Al+Fe2O3 |
| C | 将SO2气体通入氢硫酸溶液中 | 有黄色浑浊产生 | 还原性:H2S>SO2 |
| D | 制备CuSO4 | 方法一:用Cu与浓硫酸反应 方法二:用Cu与稀硫酸在不断通入O2的情况下反应 | 方法二更符合绿色化学理念 方法一的原子利用率更高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,但纤维素与淀粉不是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 将盛有CH4与Cl2的集气瓶放在光亮处一段时间 | 气体颜色变浅,瓶内壁附有油状物 |
| B | 将乙烯在空气中点燃 | 火焰呈蓝色并伴有黑烟 |
| C | 向盛有苯的试管中加入几滴酸性KMnO4溶液,充分振荡 | 液体分层,溶液紫色褪去 |
| D | 将蔗糖溶液与稀硫酸混合水浴加热,取反应后的溶液少量,加入几滴新制的Cu(OH)2悬浊液加热 | 出现砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
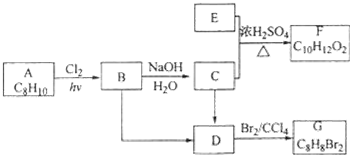
科目:高中化学 来源: 题型:推断题
 .
.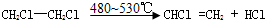 ;
;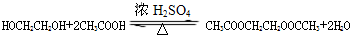 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ③④⑤⑥ | C. | ②④⑤⑦ | D. | ①②④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
. (填结构简式)
(填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com