
下表所列各组物质中,不能通过一步反应实现如图所示转化的是

物质 选项 | a | b | c |
A | Si | Na2SiO3 | SiO2 |
B | Fe | FeCl3 | FeCl2 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | Na2O2 | Na2CO3 | NaOH |
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是
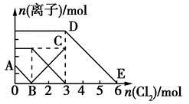
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中n(FeBr2)=3 mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是
A.原混合物中CuO与Fe2O3物质的量的比为1∶2
B.原混合物中CuO与Fe2O3的质量比为2∶1
C.吸收CO2后溶液中一定有Ba(HCO3)2
D.反应中生成的CO2体积为1.792 L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:填空题
【物质结构与性质】
天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中 (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见下表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3o | 一60.75 |
H2Se | 1.47 | 91.0o | 一41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线(如下图所示)以HA表示酸,下列说法正确的是( )

A、滴定盐酸的曲线是图2
B、达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C、达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D、当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:填空题
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:_______________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_______________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是___。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2L正丁烷所含共用电子对数为7NA
B.常温常压下,5.6g乙烯与丁烯的混合物中含有氢原子的数目为0.8NA
C.在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA
D.将CO2通过Na2O2使其增重a g时,反应中转移电子数为
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:简答题
【化学与技术】
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。

(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A饱和食盐水 B碱石灰 C浓硫酸 D蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学反应方程式为 ,此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5)科学家最近又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:简答题
【化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
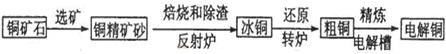
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。

在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com