
下列有关化学用语表示正确的是 
A.质子数为53、中子数为78的碘原子:131 53I B.S2-的结构示意图:
C.N2的电子式: 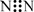 D.NH4I的电子式:
D.NH4I的电子式: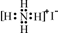
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-的物质的量浓度之比为( )
A.15∶2 B.1∶1 C.3∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3作冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
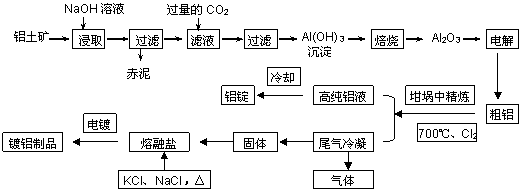
(1)赤泥中的主要成分是 (化学式);向滤液中通入过量CO2所发生反应的离子方程式为 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
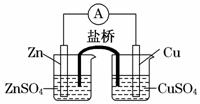
关于如图所示的原电池,下列说法正确的是
A.电子从铜电极通过检流计流向锌电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A 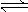 H++HA-,HA-
H++HA-,HA- 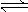 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 ;
(2)c(H2A)最大的是 ,最小的是 ;
(3)c(A2-)最大的是 ,最小的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
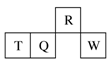
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.原子半径:T>Q>R
C.最高价氧化物对应水化物的酸性:Q<W
D.含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193 K,沸点为411K,遇水很容易反应,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得。下列有关说法 不正确的是
不正确的是
A.S2Cl2分子中各原子均达到8电子稳定结构
B.制备S2Cl2的反应是化合反应,不是氧化还原反应
C.S2Cl2遇水反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl
D.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10 mol·L-1的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 ( )
A.a的浓度必小于乙酸的浓度
B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度
D.b的浓度必大于乙酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
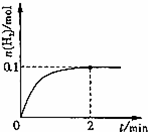
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)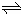 H2(g)+I2(g)反应, H2物质的量随时间的变化如上图所示.0~2min内的平均反应速率v(HI)=__________; 该温度下,H2(g)+I2(g)
H2(g)+I2(g)反应, H2物质的量随时间的变化如上图所示.0~2min内的平均反应速率v(HI)=__________; 该温度下,H2(g)+I2(g)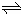 2HI(g)的平衡常数K=__________相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则__________是原来的2倍.(填序号)
2HI(g)的平衡常数K=__________相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则__________是原来的2倍.(填序号)
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡__________移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的__________,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com