
| A. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| B. | 含有羟基的化合物属于醇类 | |
| C. | 羟基跟链烃基直接相连的化合物属于醇类 | |
| D. | 分子内含有苯环和羟基的化合物都属于酚类 |
分析 A.酚具有酸性,而醇为中性;
B.-OH与烃基相连为醇,而与苯环直接相连为酚;
C.羟基跟链烃基直接相连为醇;
D.苯环和羟基不直接相连为醇.
解答 解:A.酚具有酸性,而醇为中性,则酚类和醇类具有相同的官能团,但化学性质不同,故A错误;
B.-OH与烃基相连为醇,而与苯环直接相连为酚,如苯酚中苯环与-OH直接相连,故B错误;
C.羟基跟链烃基直接相连为醇,如甲醇、乙醇等,故C正确;
D.苯环和羟基不直接相连为醇,如苯甲醇,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质等为解答的关键,侧重分析与应用能力的考查,注意酚与醇的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
 的链节为
的链节为 .其单体的结构简式分别为
.其单体的结构简式分别为 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
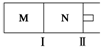 M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| B. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| C. | 若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.4mol A时,v正>v逆 | |
| D. | 起始时,分别向M、N两个容器中加入1molA和1molC,达到平衡时,容器M、N中物质A的体积分数:M<N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取碳酸钠晶体53.0g | |
| B. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| C. | 定容时,俯视观察刻度线 | |
| D. | 定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质均为高分子化合物 | |
| B. | 利用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| C. | 煤中含有苯、甲苯等,可通过煤的干馏制取 | |
| D. | 苯滴入溴水中振荡后水层接近无色,因为发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com