
下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 → HCO3-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH-+2HCO3- → CaCO3↓+ CO32-+ 2H2O
C.向0.2 mol溴化亚铁溶液中通入0.2 mol氯气:2Fe2++4Br-+3Cl2 → 2Fe3++6Cl-+2Br2
D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-→ BaSO4↓+H2O
科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 实验现象 |
| 1,用砂纸打磨后的镁条与沸水反应,再向反应液中滴加酚酞 2,向新制的H2S饱和溶液中滴加新制的氯水 3,钠与滴有酚酞试液的冷水反应 4,镁条与amol/L的盐酸反应 5,铝条与bmol/L的盐酸反应 6,向AlCl3溶液中滴加NaOH溶液至过量 |
I.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 I I.放出无色气体,气体可燃,溶液变浅红色 III.反应不十分强烈,产生的气体可燃 IV.剧烈反应,产生的气体可燃 V.生成白色絮状沉淀,继而沉淀消失 VI.生成淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、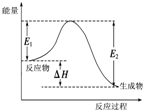 图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 | B、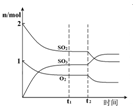 图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | C、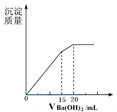 图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | D、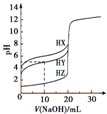 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图中曲线可确定HX的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)甲池中正极上的实验现象是_________________________________________________。
(2)乙池中总反应的离子方程式为_______________________________________________。
(3)上述实验证明了“利用金属活动性顺序表直接判断原电池正负极”,这种作法________(“可靠”或“不可靠”),如不可靠,请你提出另一种判断原电池正负极的可行的方案______________。(若你认为可靠,此空可不做答)
(4)一段时间后,乙学生将乙池两极取出,然后取少许乙池溶液逐滴滴加6 mol·L-1 H2SO4直至过量,可能观察到的现象是________________________________________,各阶段对应的离子方程式分别是____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省清远市英德中学高一(上)第三次周测化学试卷(解析版) 题型:解答题
| 实验方案 | 实验现象 |
| 1,用砂纸打磨后的镁条与沸水反应,再向反应液中滴加酚酞 2,向新制的H2S饱和溶液中滴加新制的氯水 3,钠与滴有酚酞试液的冷水反应 4,镁条与amol/L的盐酸反应 5,铝条与bmol/L的盐酸反应 6,向AlCl3溶液中滴加NaOH溶液至过量 | I.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 I I.放出无色气体,气体可燃,溶液变浅红色 III.反应不十分强烈,产生的气体可燃 IV.剧烈反应,产生的气体可燃 V.生成白色絮状沉淀,继而沉淀消失 VI.生成淡黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com