
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极精炼铜时,电解质溶液没有变化 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
分析 A、原电池中负极失电子和电解池的阳极发生氧化反应;
B、电解精炼时,根据阴阳极上铜的质量变化判断溶液中铜离子浓度是否变化;
C、用惰性电极电解饱和NaCl溶液,发生2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
D、铁、锡和合适的电解质溶液构成的原电池中,铁作负极,易被腐蚀,锌、铁和合适的电解质溶液构成的原电池中,锌作负极,铁作正极被保护.
解答 解:A、原电池中负极失电子和电解池的阳极发生氧化反应,而不是电解池的阴极,故A错误;
B、电解精炼铜时,阳极上溶解的金属不仅有铜还有其它金属,阴极上只析出铜,所以溶解的铜小于析出的铜,导致溶液中铜离子浓度减小,故B错误;
C、用惰性电极电解饱和NaCl溶液,发生2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,若有1mol电子转移,则生成1mol NaOH,故C正确;
D镀层破损后,镀锡铁板中铁加快腐蚀,镀锌铁板中铁被保护,所以镀锌铁板比镀锡铁板更耐腐蚀,故D错误;
故选C.
点评 本题考查原电池和电解池的工作原理,为高考常见题型,注意把握工作原理和离子的放电顺序,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸和氢氧化铜 | B. | 硫酸和氢氧化钠溶液 | ||
| C. | 醋酸和氢氧化钡溶液 | D. | 稀硝酸和氨水混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子能做不停的,无规则的运动 | |
| B. | 是否有丁达尔现象 | |
| C. | 静置后既不分层,也无沉淀产生 | |
| D. | 分散质粒子直径在10-7-10-9m之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质浓度(mol/L)时间(min) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16mo1 | B. | 19 mol | C. | 20mol | D. | 23mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称是2,5,5-三甲基-3-乙基庚烷 的名称是2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将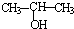 与NaOH的醇溶液共热可制备CH3-CH═CH2 与NaOH的醇溶液共热可制备CH3-CH═CH2 | |
| C. | 向柠檬醛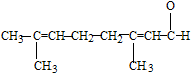 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 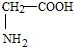 、 、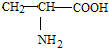 、 、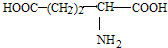 三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素的氢化物中只有极性键没有非极性键 | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 三种元素的气态最简单氢化物中Z的氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com