
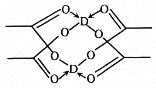
”¾ĢāÄæ”æŠæŅųµē³ŲµÄøŗ¼«ĪŖŠæ£¬Õż¼«ĪŖŃõ»ÆŅų£¬µē½āÖŹŹĒKOH£¬µē³Ų·“Ó¦ĪŖZn£«Ag2O£«H2O=Zn(OH)2£«2Ag”£ŅŌŠæŅųµē³ŲĪŖµēŌ“£¬µē½āĮņĖįÄųČÜŅŗŅ±Į¶“æÄų£¬×°ÖĆČēĶ¼ĖłŹ¾”£
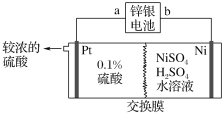
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.×°ÖĆÖŠŹ¹ÓĆŅõĄė×Ó½»»»Ä¤
B.ŠæŅųµē³Ųa¼«·“Ó¦Ź½ĪŖAg2O£«H2O£«2e£=2Ag£«2OH£
C.×ó²ąČō¼ÓČėĻ”ŃĪĖį£¬µē½āŗóµĆµ½±Č½ĻÅصÄŃĪĖį
D.ČōŠæŅųµē³ŲČܽā13gŠæ£¬ŌņÄų¼«¾»ŌöÖŹĮæ×ī¶ąĪŖ5.9g
”¾“š°ø”æAB
”¾½āĪö”æ
A. ½»»»Ä¤×ó²ąĮ÷³öĮņĖįÅضČŌö“ó£¬ĖµĆ÷ĮņĖįøłĄė×Ó“ÓÓŅ²ąŅĘĻņ×ó²ą£¬ĖłŅŌ×°ÖĆÖŠŹ¹ÓĆŅõĄė×Ó½»»»Ä¤£¬¹ŹAÕżČ·£»
B. µē½āĮņĖįÄųČÜŅŗŅ±Į¶“æÄų£¬ĖłŅŌµē½ā³ŲÓŅ²ąŹĒŅõ¼«£¬ŠæŅųµē³ŲµÄb¼«ŹĒøŗ¼«£¬aŹĒÕż¼«·¢Éś»¹Ō·“Ó¦£¬a¼«·“Ó¦Ź½ĪŖAg2O£«H2O£«2e£=2Ag£«2OH££¬¹ŹBÕżČ·£»
C. ×ó²ąČō¼ÓČėĻ”ŃĪĖį£¬Ńō¼«ĀČĄė×ӷŵēÉś³ÉĀČĘų£¬¹ŹC“ķĪó£»
D. ČōŠæŅųµē³ŲČܽā13gŠæ£¬ŌņµēĀ·ÖŠ×ŖŅʵē×Ó![]() 0.4mol£¬ŌņÄų¼«¾»ŌöÖŹĮæ×ī¶ąŹĒ
0.4mol£¬ŌņÄų¼«¾»ŌöÖŹĮæ×ī¶ąŹĒ![]() 11.8g£¬¹ŹD“ķĪó£»
11.8g£¬¹ŹD“ķĪó£»
¹ŹŃ”AB”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½Ģ²Ä²åĶ¼¾ßÓŠ¼ņ½ą¶ųÓÖÄŚŗ·įø»µÄĢŲµć”£Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
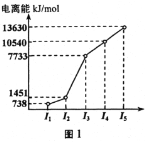
£Ø1£©µŚČżÖÜĘŚµÄijÖ÷×åŌŖĖŲ£¬Ę䵌Ņ»ÖĮµŚĪåµēĄėÄÜŹż¾ŻČēĶ¼1ĖłŹ¾£¬ŌņøĆŌŖĖŲ¶ŌÓ¦µÄŌ×ÓÓŠ___ÖÖ²»Ķ¬ŌĖ¶ÆדĢ¬µÄµē×Ó”£
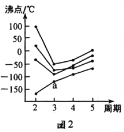
£Ø2£©ČēĶ¼2ĖłŹ¾£¬ĆæĢõÕŪĻß±ķŹ¾ÖÜĘŚ±ķ¢ōA-¢÷AÖŠµÄijŅ»×åŌŖĖŲĒā»ÆĪļµÄ·Šµć±ä»Æ”£ĆæøöŠ”ŗŚµć“ś±ķŅ»ÖÖĒā»ÆĪļ£¬ĘäÖŠaµć“ś±ķµÄŹĒ___”£
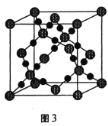
£Ø3£©CO2ŌŚøßĪĀøßŃ¹ĻĀĖłŠĪ³ÉµÄ¾§ĢåĘ侧°ūČēĶ¼3ĖłŹ¾”£ŌņøĆ¾§ĢåµÄĄąŠĶŹōÓŚ___¾§Ģ唣
£Ø4£©µŚŅ»µēĄėÄܽéÓŚAl”¢PÖ®¼äµÄµŚČżÖÜĘŚŌŖĖŲÓŠ___ÖÖ”£GaCl3Ō×ÓµÄŌӻƷ½Ź½ĪŖ___”£
£Ø5£©±ł”¢øɱł”¢µā¶¼ŹĒ·Ö×Ó¾§Ģ壬±łµÄ½į¹¹¾ßÓŠĢŲŹāŠŌ£¬¶ųøɱł”¢µāµÄ¾§Ģå¾ßÓŠĻąĖĘµÄ½į¹¹ĢŲÕ÷£¬øɱł·Ö×ÓÖŠŅ»øö·Ö×ÓÖÜĪ§ÓŠ___øö½ōĮŚ·Ö×Ó”£DµÄ“×ĖįŃĪ¾§Ģå¾Ö²æ½į¹¹ČēĶ¼£¬øĆ¾§ĢåÖŠŗ¬ÓŠµÄ»Æѧ¼üŹĒ___£ØĢī×ÖÄø±źŗÅ£©”£
a£®¼«ŠŌ¼ü b£®·Ē¼«ŠŌ¼ü c£®ÅäĪ»¼ü d£®½šŹō¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¢ń.“Óŗ£Ė®µĆµ½µÄ“ÖŹ³ŃĪĖ®ÖŠ³£ŗ¬Ca2£«”¢Mg2£«”¢SO42-£¬ŠčŅŖ·ÖĄėĢį“攣ĻÖÓŠŗ¬ÉŁĮæCaCl2”¢MgSO4µÄ“ÖŹ³ŃĪĖ®£¬ŌŚ³żČ„Šüø”ĪļŗĶÄąÉ³Ö®ŗó£¬ŅŖÓĆ4ÖÖŹŌ¼Į¢ŁŃĪĖį”¢¢ŚNa2CO3”¢¢ŪNaOH”¢¢ÜBaCl2Ą“³żČ„Ź³ŃĪĖ®ÖŠCa2£«”¢Mg2£«”¢SO42-”£Ģį“æµÄ²Ł×÷²½ÖčŗĶ¼ÓČėŹŌ¼ĮµÄĒéæöČēĶ¼£ŗ
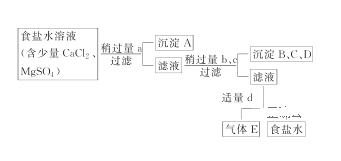
Ķ¼ÖŠa”¢b”¢c”¢d·Ö±š±ķŹ¾ÉĻŹö4ÖÖŹŌ¼ĮÖŠµÄŅ»ÖÖ£¬ŹŌ»Ų“š£ŗ
(1)³ĮµķAµÄĆū³ĘŹĒ________”£
(2)ŹŌ¼ĮdŹĒ________£»ÅŠ¶ĻŹŌ¼ĮdŅŃ¾×ćĮæµÄ·½·ØŹĒ___________________”£
¼ÓČėŹŹĮædŗóČÜŅŗÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________________________”£
(3)ĻÖÓŠĻĀĮŠŅĒĘ÷£¬¹żĀĖ³ö³ĮµķA”¢B”¢C”¢DŹ±±ŲŠėÓƵ½________(ĢīŠņŗÅ)£¬ŅĒĘ÷¢ŪµÄĆū³ĘŹĒ________”£
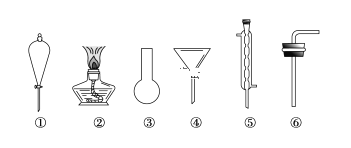
¢ņ.ŗ£Ė®ÕōĮóŹĒÓÉŗ£Ė®»ńµĆµĖ®µÄ³£ÓĆ·½·ØÖ®Ņ»£¬ŌŚŹµŃéŹŅĄļ×é³ÉŅ»Ģ×ÕōĮó×°ÖĆæĻ¶ØŠčŅŖÉĻŹöŅĒĘ÷ÖŠµÄŅ»²æ·Ö£¬ŌņÕżČ·µÄŹĒ________(ĢīŠņŗÅ)”£
¢ó.ŗ£“ųµČŌåĄąĪļÖŹ¾¹ż“¦Ąķŗó£¬æÉŅŌµĆµ½µāĖ®£¬Óū“ÓµāĖ®ÖŠĢįČ”µā£¬ŠčŅŖÉĻŹöŅĒĘ÷ÖŠµÄ________(ĢīŠņŗÅ)£¬øĆŅĒĘ÷Ćū³ĘĪŖ________£¬ĻņøƵāĖ®ÖŠ¼ÓČėĖÄĀČ»ÆĢ¼ŅŌĢįČ”µāµ„ÖŹµÄŹµŃé²Ł×÷ĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃõ»Æ»¹Ō·“Ó¦ŹĒÖŲŅŖµÄ»Æѧ·“Ó¦£¬ŌŚČĖĄąµÄÉś²śŗĶÉś»īÖŠĪŽ“¦²»ŌŚ”£
£Ø1£©ŅŃÖŖ·“Ó¦£ŗBaSO4£«C”Ŗ”ŖBaS£«CO”ü
¢ŁÅäĘ½øĆ·“Ó¦___”£
¢ŚČōÓŠ2.33gBaSO4·¢Éś·“Ó¦£¬Ōņ·“Ó¦¹ż³ĢÖŠ×ŖŅʵē×ӵďżÄæŹĒ__£¬±ź×¼×“æöĻĀ£¬Éś³ÉŅ»Ńõ»ÆĢ¼___L”£
£Ø2£©ŅŃÖŖ·“Ó¦£ŗCu+HNO3(Ļ”)”Ŗ”ŖCu(NO3)2+NO”ü+H2O£»
¢ŁÅäĘ½²¢ÓĆ”°Ė«ĻßĒÅ·Ø”±±ķŹ¾ÉĻŹö·“Ó¦ÖŠµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ___”£
¢ŚøĆ·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ__£»Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÖŠæĘŌŗæĘѧ¼ŅÉč¼Ę³öŅ»ĢץūÓĆSO2ŗĶĢ«ŃōÄÜ×ŪŗĻÖĘĒā·½°ø£¬Ę仳±¾¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
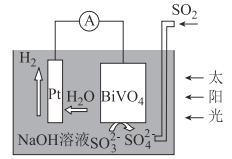
A. øƵē»ÆѧװÖĆÖŠ£¬Ptµē¼«×÷Õż¼«
B. BiVO4µē¼«ÉĻµÄ·“Ó¦Ź½ĪŖSO32--2e-+2OH=SO42-+H2O
C. µē×ÓĮ÷Ļņ£ŗPtµē¼«”śµ¼Ļß”śBiVO4µē¼«”śµē½āÖŹČÜŅŗ”śPtµē¼«
D. Ptµē¼«µÄµēŹĘøßÓŚBiVO4µē¼«µÄµēŹĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶųŹÜµ½¹Ų×¢£¬ĻĀ±ķĪŖÖĘČ”Cu2OµÄĮ½ÖÖ·½·Ø£ŗ
·½·Øa | ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuO |
·½·Øb | µē½ā·Ø£¬·“Ó¦ĪŖ2Cu+H2O |
£Ø1£©¹¤ŅµÉĻ³£ÓĆ·½·ØbÖĘČ”Cu2O¶ųŗÜÉŁÓĆ·½·Øa£¬ĘäŌŅņŹĒ·“Ó¦Ģõ¼ž²»Ņ×æŲÖĘ£¬ČōæŲĪĀ²»µ±Ņ×Éś³É___¶ųŹ¹Cu2O²śĀŹ½µµĶ”£
£Ø2£©ŅŃÖŖ£ŗ¢Ł2Cu(s)+![]() O2(g)=Cu2O(s) ¦¤H1=£169kJ”¤mol£1
O2(g)=Cu2O(s) ¦¤H1=£169kJ”¤mol£1
¢ŚC(s)+![]() O2(g)=CO(g) ¦¤H2=£110.5 kJ”¤mol£1
O2(g)=CO(g) ¦¤H2=£110.5 kJ”¤mol£1
¢ŪCu(s)+![]() O2(g)=CuO(s) ¦¤H3=£157 kJ”¤mol£1
O2(g)=CuO(s) ¦¤H3=£157 kJ”¤mol£1
Ōņ·½·ØaÖŠ·¢ÉśµÄ·“Ó¦£ŗ2CuO(s)£«C(s)=Cu2O(s)£«CO(g)£»”÷H=___”£
£Ø3£©·½·ØbŹĒÓĆėĀČ¼ĮĻµē³ŲĪŖµēŌ“£¬ĶعżĄė×Ó½»»»Ä¤µē½ā·ØæŲÖʵē½āŅŗÖŠOH£µÄÅØ¶ČĄ“ÖʱøÄÉĆ×Cu2O£¬×°ÖĆČēĶ¼ĖłŹ¾£ŗ
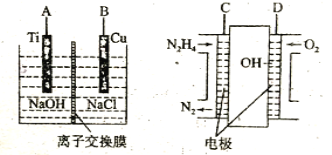
¢ŁÉĻŹö×°ÖĆÖŠBµē¼«Ó¦Į¬___µē¼«(Ģī”°C”±»ņ”°D”±)”£
¢ŚøĆĄė×Ó½»»»Ä¤ĪŖ___Ąė×Ó½»»»Ä¤(Ģī”°Ņõ”±»ņ”°Ńō”±)£¬øƵē½ā³ŲµÄŃō¼«·“Ó¦Ź½ĪŖ___”£
¢ŪŌµē³ŲÖŠøŗ¼«·“Ó¦Ź½ĪŖ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌĖ®ŃłÖŠČÜÖŹMµÄ·Ö½āĖŁĀŹÓ°ĻģŅņĖŲ½ųŠŠŃŠ¾æ”£ŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬MµÄĪļÖŹµÄĮæÅضČ(mol”¤L-1)Ėꏱ¼ä(min)±ä»ÆµÄÓŠ¹ŲŹµŃ鏿¾Ż¼ūĻĀ±ķ”£
Ź±¼ä Ė®Ńł | 0 | 5 | 10 | 15 | 20 | 25 |
I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
¢ó(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
IV(pH=4£¬ŗ¬ Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A.ÓÉÓŚCu2+“ęŌŚ£¬IVÖŠMµÄ·Ö½āĖŁĀŹ±ČIæģ
B.ĘäĖüĢõ¼žĻąĶ¬Ź±£¬Ė®ŃłĖįŠŌŌ½Ē棬MµÄ·Ö½āĖŁĀŹŌ½æģ
C.ŌŚ0”«25 minÄŚ£¬¢óÖŠMµÄ·Ö½ā°Ł·ÖĀŹ±ČII
D.ŌŚ0”«20 minÄŚ£¬IÖŠMµÄĘ½¾ł·Ö½āĖŁĀŹĪŖ0.015mol/(L”¤min)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢśŹĒČĖĄą½ĻŌēŹ¹ÓĆµÄ½šŹōÖ®Ņ»”£ŌĖÓĆĖłŃ§ÖŖŹ¶£¬»Ų“šĻĀĮŠĪŹĢā”£
£Ø1£©¼ņµ„¼ų±šFe(OH)3½ŗĢåŗĶFeCl3ČÜŅŗµÄ·½·ØŹĒ_______________”£
£Ø2£©µē×Ó¹¤ŅµÓĆFeCl3ČÜŅŗøÆŹ“·óŌŚ¾ųŌµ°åÉĻµÄĶ£¬ÖĘŌģÓ”Ė¢µēĀ·°å£¬ĒėÓĆĖ«ĻßĒűķŹ¾³öµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ_____________________
£Ø3£©Ä³ŃŠ¾æŠŌѧĻ°Š”×éĪŖ²ā¶ØFeCl3øÆŹ“ĶŗóĖłµĆČÜŅŗµÄ×é³É£¬½ųŠŠĮĖČēĻĀŹµŃé£ŗ
¢ŁČ”ÉŁĮæ“ż²āČÜŅŗ£¬µĪČėKSCNČÜŅŗ³ŹŗģÉ«£¬Ōņæɼģ³ö“ż²āŅŗÖŠŗ¬ÓŠµÄ½šŹōŃōĄė×ÓŹĒ_____£»
¢ŚŃéÖ¤øĆČÜŅŗÖŠŗ¬ÓŠFe2+£¬ÕżČ·µÄŹµŃé·½·ØŹĒ_______£ØÓĆ×ÖÄø“śŗÅĢī£©”£
A£®¹Ū²ģČÜŅŗŹĒ·ń³ŹĒ³ĀĢÉ«
B£®Č”ŹŹĮæČÜŅŗ£¬µĪČėĖįŠŌøßĆĢĖį¼ŲČÜŅŗ£¬ČōĶŹÉ«£¬Ö¤Ć÷ŗ¬ÓŠFe2+
C£®Č”ŹŹĮæČÜŅŗ£¬µĪČėĀČĖ®£¬ŌŁµĪČėKSCNČÜŅŗ£¬ČōĻŌŃŖŗģÉ«£¬Ö¤Ć÷ŌČÜŅŗÖŠŗ¬ÓŠFe2+
£Ø4£©¹¤³ĢŹ¦Óū“ÓÖĘŌģÓ”Ė¢µēĀ·°åµÄ·ĻĖ®ÖŠ»ŲŹÕĶ£¬²¢»ńµĆFeCl3ČÜŅŗ£¬Éč¼ĘČēĻĀ·½°ø£ŗ
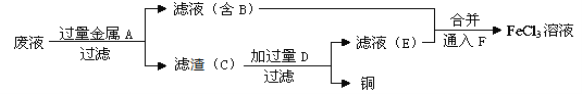
¢ŁĀĖŌüCµÄÖ÷ŅŖ³É·ÖµÄ»ÆѧŹ½ĪŖ_______”¢_______”£
¢Ś¼Ó¹żĮæD·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________________________”£
¢ŪĶØČėF·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ___________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ³£ĪĀĻĀĢ¼Ėį”¢ŃĒĮņĖį”¢“ĪĀČĖįµÄµēĄėĘ½ŗā³£ŹżČēĻĀ±ķ:
H2CO3 | H2SO3 | HClO |
K1=4.30”Į10-7 | K1=1.54”Į10-2 | K=2.95”Į10-8 |
K2=5.61”Į10-11 | K2=1.02”Į10-7 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ĻąĶ¬Ģõ¼žĻĀ,Ķ¬ÅØ¶ČµÄ H2SO3ČÜŅŗŗĶ H2CO3ČÜŅŗµÄĖįŠŌ£¬ ŗóÕßøüĒæ
B. Na2CO3ČÜŅŗÖŠĶØČėÉŁĮæSO2£ŗ 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO ČÜŅŗÖŠĶØČėÉŁĮæCO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. ĻņĀČĖ®ÖŠ·Ö±š¼ÓČėµČÅØ¶ČµÄ NaHCO3 ŗĶ NaHSO3ČÜŅŗ,¾łæÉĢįøßĀČĖ®ÖŠ HClO µÄÅضČ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com